박테리아 단백질 발현
E. coli는 짧은 생산 시간, 기술적 단순성, 확장성 및 저렴한 비용 등 여러 장점으로 인해 재조합 단백질 생산에 가장 널리 사용되는 숙주입니다. VectorBuilder는 수용성 및 불용성 단백질은 물론 cytoplasmic 및 periplasmic 발현을 위해 최적화된 워크플로우를 통해 박테리아에서 재조합 단백질을 생산하는데 특화되어 있습니다.
중점 사항
- 저비용, 높은 수율, 스케일업 용이
- 수용성 단백질과 inclusion body 모두에 최적화된 전략
- 최대의 최적화를 위해 다양한 벡터 백본과 박테리아 균주를 사용 가능
서비스 세부 사항
가격 및 소요시간 Price Match
| Service Module | Brief Description | Deliverables | Price (USD) | Turnaround |
|---|---|---|---|---|
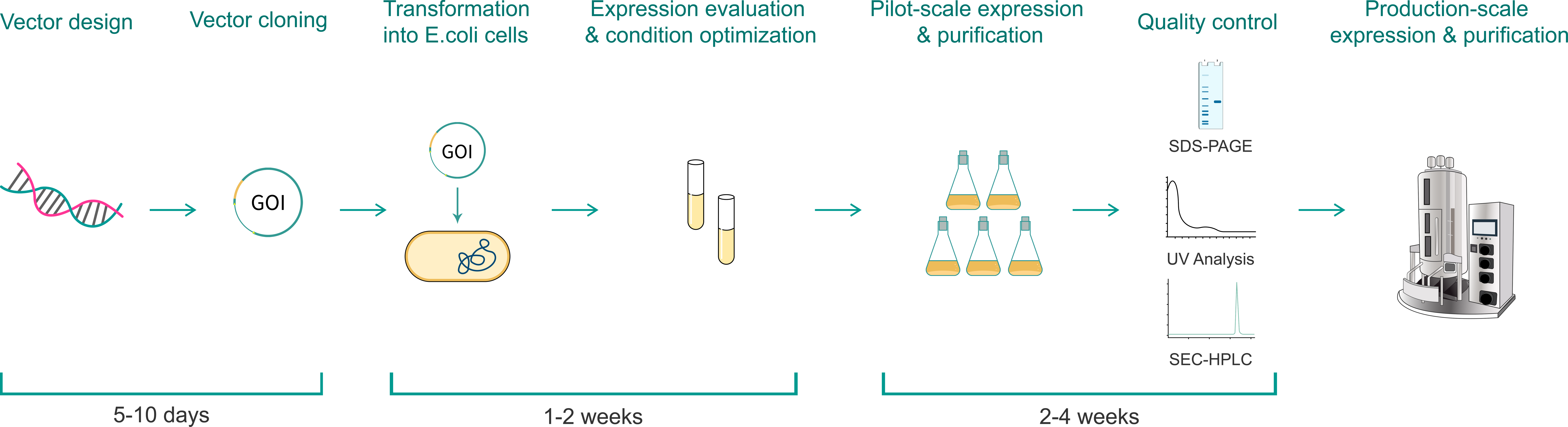
| Vector design and cloning | Vector design includes fusion partner selection, purification tag selection, and codon optimization. This is followed by gene synthesis and cloning into the bacterial recombinant protein expression vector, such as the pET. | E. coli glycerol stock | From $139 | 5-10 days |
| Expression evaluation and condition optimization | The expression vector is transformed into the appropriate host strain, such as BL21 (DE3). A small-batch evaluation will be conducted with various conditions, and the expression and solubility of the target protein will be assessed *. | Expression evaluation report | From $600 | 1-2 weeks |
| Pilot-scale expression and purification | Based on the evaluation from the last step, 0.5-1 mg of purified target proteins ** can be produced if feasible, and quality control (QC) will be performed. |
|
From $1,200 | 2-4 weeks |
| Production-scale expression and purification | Scaled up production of >100 mg of purified proteins. |
|
Please inquire | |
* 단백질이 inclusion body를 형성하면 solubilization 과정을 거쳐 리폴딩되고 정제됩니다. 적절한 리폴딩 전략은 단백질의 서열과 구조적 특성을 기반으로 결정됩니다. 이에 따라 가격이 조정될 수 있습니다.
** 정제 방법은 컨스트럭트 디자인 및 단백질 특성에 따라 결정됩니다.
배송 및 보관
대부분의 재조합 단백질은 드라이아이스에 냉동 상태로 전달됩니다. 수령 후 멸균 상태에서 -20°C ~ -80°C에 보관해야 합니다. 재조합 단백질은 적절하게 보관할 경우 일반적으로 최대 1년 동안 안정성을 유지합니다. 또한 수령 후 재조합 단백질을 분주하여 저장하는 것을 권장하며, 동결-해동 반복은 피하시기 바랍니다.
품질관리 (QC)
VectorBuilder에서 클로닝된 모든 벡터는 100% 서열을 보증합니다. VectorBuilder가 생산하는 모든 재조합 단백질은 엄격한 품질관리를 받습니다. 대부분의 시스템에 대한 기본 QC에는 1) 제한효소 절단 분석 및 Sanger 시퀀싱을 통한 단백질 발현 벡터의 검증, 및 2) A260/280 측정 및 SDS-PAGE에 의한 단백질 농도 및 순도 측정이 포함됩니다. 일반적인 추가 QC 서비스는 아래 표에 나와 있으며 별도 요청시 제공될 수 있습니다.
| Additional QC services | Method |
|---|---|
| Endotoxin test | LAL |
| Protein characterization | Western Blot |
| Intact MS (reduced) | |
| SEC-HPLC | |
| SEC-MALs | |
| Protein N-terminal sequencing | |
| Host cell protein test | |
| Tag removal | Protease digestion |
| Kinetics and affinity analysis | Octet |
| Biacore | |
| Pathogen testing panel for rodents | |
기술적인 정보
벡터 시스템
박테리아 재조합 단백질 발현을 위한 일반적인 벡터 시스템에는 pET, pBAD, pCS 등이 있습니다. 그중 pET 벡터는 강력하고 널리 사용되는 시스템입니다. 관심 유전자는 강력한 bacteriophage T7 전사 및 번역 조절 시스템에 제어되는 pET 벡터에 클로닝 됩니다. 세포 내에서 T7 RNA polymerase를 제공함으로써 발현이 활성화됩니다. 시스템이 완전히 유도되면 거의 모든 세포 자원이 관심 유전자를 발현하는데 사용됩니다. 아래 맵에는 pET 재조합 단백질 발현 벡터의 주요 구성요소가 포함되어 있습니다.
VectorBuilder의 박테리아 단백질 발현 벡터 시스템에 대한 자세한 내용은 벡터 가이드를 참조 하세요.
Figure 1. pET 박테리아 재조합 단백질 발현 벡터의 맵.
사례 연구
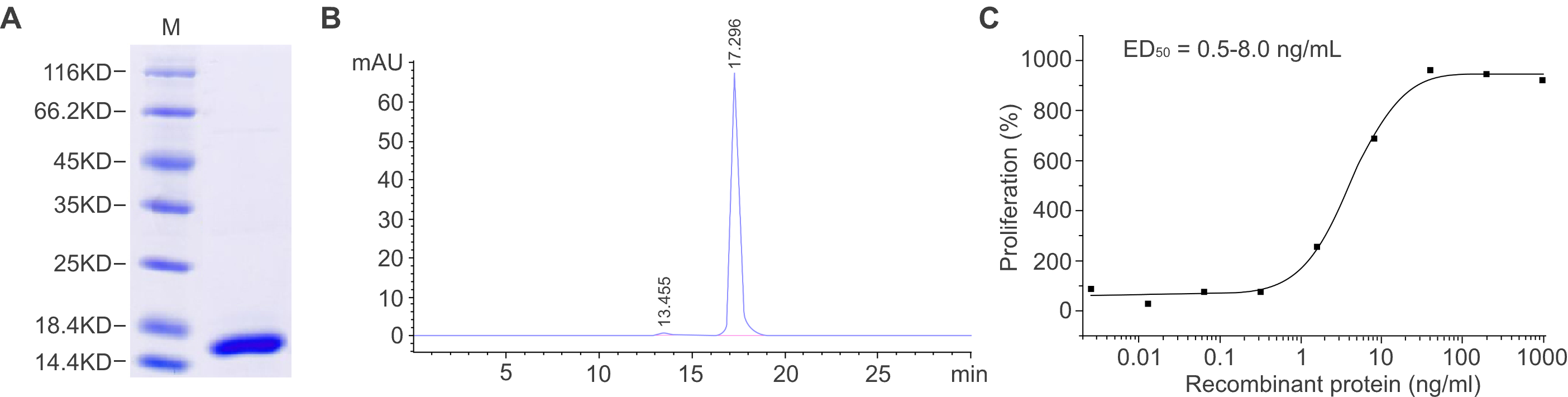
Figure 2. E. coli 시스템으로 생산된 재조합 단백질의 특성 분석. (A) SDS-PAGE 분석은 재조합 단백질의 분자 질량을 보여주며 순도는 ≥ 95%로 확인되었습니다. (B) 순도는 SEC-HPLC에 의해 ≥ 95%로 확인되었습니다. (C) 재조합 단백질의 생물학적 활성은 cell proliferation 분석을 통해 측정되었습니다. ED50 은 0.5~8 ng/ml입니다.
주문 방법
고객이 제공하는 벡터
고객이 제공하는 시료가 필요한 경우 시료 제출 가이드라인에 따라 준비하여 VectorBuilder로 보내주십시오. 시료의 배송 지연이나 손상을 방지하기 위해 당사의 가이드라인을 엄격히 따라 시료를 준비해 주시기 바랍니다. 고객이 제공하는 모든 시료는 VectorBuilder의 필수 QC를 거치며, 각 항목에 대해 $100의 추가 요금이 부과될 수 있습니다. 고객이 제공한 시료가 QC를 통과해야만 생산을 시작할 수 있습니다.
자료
FAQ
프로젝트에 가장 적합한 시스템을 선택할 때 모든 재조합 단백질 발현 시스템은 고려해야할 장단점이 있습니다. 아래 표에는 각 시스템의 장단점이 요약되어 있습니다.
| Recombinant protein expression system | Pros | Cons |
|---|---|---|
| Bacteria |
|
|
| Mammalian cells |
|
|
| Insect |
|
|
| Cell-free system |
|
|
태그는 재조합 단백질 생산에 자주 활용됩니다. 태그는 정제 과정을 간소화하고, 특정 태그에서는 단백질 용해도, 수율 또는 순도가 향상되는 것으로 나타났습니다. Protease 절단 부위에 태그가 부착되어 있으면 정제 후 제거가 가능하며, 목적 단백질에 따라 절단 효율이 달라집니다. 적절한 태그를 신중하게 선택하는 것은 다운스트림 단백질 발현 및 정제에 매우 중요합니다. 아래 표에는 일반적으로 사용되는 태그의 개요와 장점 및 제한사항이 정리되었습니다.
| Tag | Commonly applied system | Advantages | Limitations |
|---|---|---|---|
| GST | Bacteria, insect |
|
|
| His | All |
|
|
| SUMO | Bacteria, insect |
|
|
| Flag | Mammalian cells, insect |
|
|
| MBP | Bacteria, insect |
|
|
| Fc | Mammalian cells, insect |
|
|
For more information regarding tags, please visit protein tags.
아래에 설명된 내용은 박테리아에서 재조합 단백질을 발현하는데 문제가 있을 수 있는 몇가지 일반적인 이유입니다.
Plasmid가 부적절한 host strain에 있다.
Plasmid는 부적절한 숙주 strain에서는 발현되지 않을 수 있습니다. VectorBuilder의 대부분의 벡터는 클로닝시에 VB UltraStable™를 이용합니다. VB UltraStable™은 plasmid의 안정성을 유지하는 능력 때문에 선호되는 클로닝 호스트이지만, 재조합 단백질 발현에는 적합하지 않을 수 있습니다. 재조합 단백질 생산의 경우 LacUV5 promoter에 의해 구동되는 T7 RNA polymerase 유전자의 염색체 카피를 보유하는 BL21(DE3) 또는 HMS174(DE3) 숙주 박테리아 strain으로 벡터를 이전하는 것이 좋습니다. 관심 유전자의 독성이 이러한 발현 숙주 strain에서 문제가 되는 경우, pLysS 또는 pLysE plasmid를 보유하는 숙주 strain을 사용하는 것이 유익할 수 있습니다. 이들 plasmid는 T7 RNA polymerase inhibitor인 T7 lysozyme을 생성하여 관심 유전자의 기본 발현을 억제합니다.
벡터에서 발현되는 단백질에 "문제”가 있습니다.
때때로 발현되는 단백질이 불용성이거나, 미스폴딩, 부적절하게 절단되거나, 박테리아 숙주에 독성을 나타내는 경우, 재조합 단백질의 유도가 좋지 않을 수 있습니다. 이 경우, 유도 시스템(아래 참조)을 최적화하거나, 보다 내성이 있는 숙주 strain 또는 대체 발현 시스템에서 관심 유전자를 발현해야 합니다.
유도 시스템이 최적이 아닙니다.
발현될 유전자, 발현 벡터, 숙주 strain에 따라 유도 시스템의 다양한 요인을 최적화하는 것을 고려해야 할 수도 있습니다. 여기에는 OD600 (보통 0.6~0.8), inducing agent (예: IPTG 또는 L-arabinose)의 농도, 유도 기간 및 유도 온도가 포함됩니다. '문제가 있는' 단백질을 다룰 때 유도 온도를 최적화하는 것이 특히 중요하며, 16°C, 25°C, 30°C, 37°C 등 다양한 온도를 테스트할 수 있습니다. 드문 경우지만 알 수 없는 이유로 동일한 발현 벡터의 서로 다른 클론이 서로 다른 유도 동작을 나타낼 수 있습니다. 따라서 여러 개의 단일 콜로니를 선택하여 개별적으로 테스트하고 최적의 유도 성능을 보이는 콜로니를 선택해야 할 수도 있습니다.
앞서 언급한 문제를 피하고 실제 연구에 소요되는 귀중한 시간을 절약하려면 재조합 단백질 발현 요구사항을 VectorBuilder에 아웃소싱하는 것을 고려하십시오.