곤충 단백질 발현
타겟 유전자를 발현하는 배큘로바이러스로 고밀도 곤충 세포 배양물을 감염시키는 것은 재조합 단백질의 진핵생물 발현을 위한 강력한 시스템 중 하나입니다. 곤충 발현 시스템은 진핵생물의 post-translational modification과 단백질 폴딩의 대부분을 유지합니다. 이는 kinase와 steroid receptor를 생산하는데 선호되는 접근법인 경우가 많습니다. 이들 단백질은 각각 적절한 phosphorylation이 부족하거나 미스폴딩으로 박테리아 세포에서 생산될 때 비활성 상태로 남아 있을 수 있습니다.
중점 사항
- 필수적인 진핵생물 단백질 modification을 유지
- 여러 곤충 세포주 사용 가능
- 대규모 단백질 타겟 생산에 유용
- Secreted, intracellular 및 membrane-bound 단백질 생산에 적합
서비스 세부 사항
가격 및 소요시간 Price Match
| Service Module | Brief Description | Deliverables | Price (USD) | Turnaround |
|---|---|---|---|---|
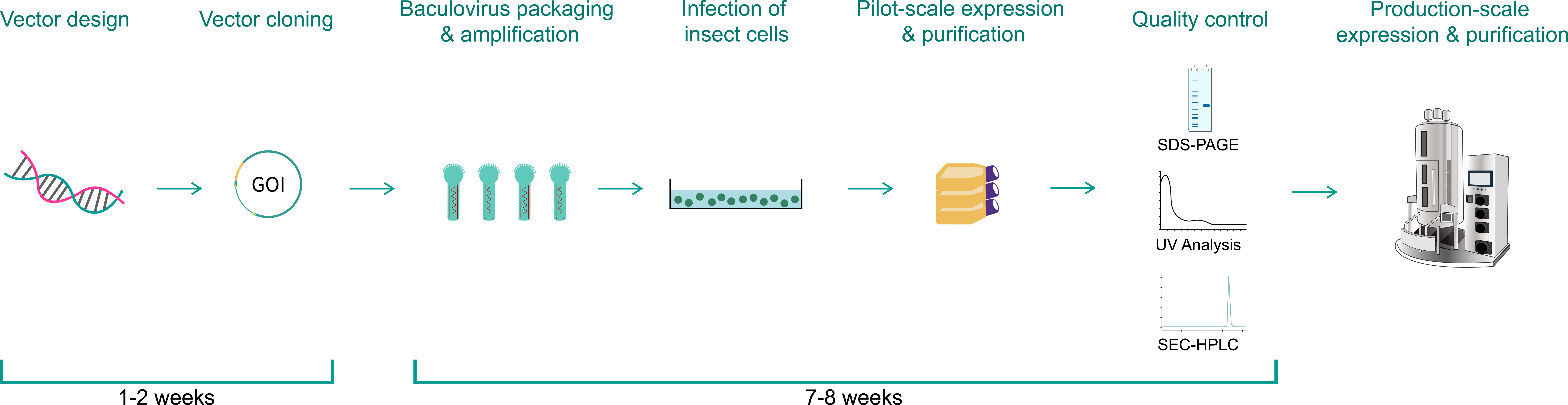
| Vector design and cloning | Vector design includes fusion partner selection, purification tag selection, and codon optimization. This is followed by gene synthesis and cloning into the baculovirus transfer vector, such as the pBV. | E. coli glycerol stock | From $160 | 1-2 weeks |
| Pilot-scale expression and purification | Baculovirus will be generated and amplified. |
|
From $2,400 | 7-8 weeks |
| Insect cells, such as Hi-5 or Sf9 cells, will be infected with the baculovirus. If feasible, 0.1-0.5 mg of purified target proteins * can be produced, and quality control (QC) will be performed. | ||||
| Production-scale expression and purification | Scaled up production of >100 mg of purified proteins. |
|
Please inquiry | |
* 정제 방법은 컨스트럭트 디자인 및 단백질 특성에 따라 결정됩니다.
배송 및 보관
대부분의 재조합 단백질은 드라이아이스에 냉동 상태로 전달됩니다. 수령 후 멸균 상태에서 -20°C ~ -80°C에 보관해야 합니다. 재조합 단백질은 적절하게 보관할 경우 일반적으로 최대 1년 동안 안정성을 유지합니다. 또한 수령 후 재조합 단백질을 분주하여 저장하는 것을 권장하며, 동결-해동 반복은 피하시기 바랍니다.
품질관리 (QC)
VectorBuilder에서 클로닝된 모든 벡터는 100% 서열을 보증합니다. VectorBuilder가 생산하는 모든 재조합 단백질은 엄격한 품질관리를 받습니다. 대부분의 시스템에 대한 기본 QC에는 1) 제한효소 절단 분석 및 Sanger 시퀀싱을 통한 단백질 발현 벡터의 검증, 및 2) A260/280 측정 및 SDS-PAGE에 의한 단백질 농도 및 순도 측정이 포함됩니다. 일반적인 추가 QC 서비스는 아래 표에 나와 있으며 별도 요청시 제공될 수 있습니다.
| Additional QC services | Method |
|---|---|
| Endotoxin test | LAL |
| Protein characterization | Western Blot |
| Intact MS (reduced) | |
| SEC-HPLC | |
| SEC-MALs | |
| Protein N-terminal sequencing | |
| Host cell protein test | |
| Tag removal | Protease digestion |
| Kinetics and affinity analysis | Octet |
| Biacore | |
| Pathogen testing panel for rodents | |
기술적인 정보
벡터 시스템
곤충 시스템에서 재조합 단백질을 발현시키기 위해, 먼저 관심 유전자(GOI)를 강력한 프로모터의 제어 하에 VectorBuilder의 pBV 벡터에 클로닝합니다. 이 전체 발현 카세트는 Tn7 transposon terminal elements인 Tn7L 및 Tn7R이 인접해 있습니다. 그런 다음 이 벡터는 bacmid shuttle 벡터와 helper plasmid를 운반하는 E. coli로 형질전환됩니다. Bacmid는 본질적으로 lacZ 유전자와 lacZ 코딩 영역에 삽입된 attTn7 docking site를 운반하도록 변형된 배큘로바이러스 게놈을 포함하는 매우 큰 플라스미드입니다. Helper plasmid는 Tn7 transposase를 발현합니다. 그런 다음 transposase는 관심 유전자 및 약물 내성 유전자에 대한 발현 카세트를 포함하는 pBV 벡터의 Tn7R 및 Tn7L 인접 영역을 bacmid의 attTn7 도킹 사이트로 transposition 시키는 것을 매개합니다. 재조합 bacmid를 함유한 콜로니는 약물 선택 및 blue/white 스크리닝으로 식별할 수 있습니다(비재조합 콜로니는 lacZ 발현으로 인해 파란색인 반면, 재조합 콜로니는 transposon 삽입에 의한 lacZ의 파괴로 인해 흰색임). 그런 다음 정제된 bacmid DNA를 사용하여 곤충 세포를 형질감염시켜 살아있는 배큘로바이러스(P1)를 생성할 수 있습니다. P1 배큘로바이러스는 곤충 세포에서 증폭되어 적합한 역가를 달성하며, 이는 곤충 세포를 감염시켜 관심 있는 재조합 단백질을 생산하는데 사용될 수 있습니다.
VectorBuilder의 배큘로바이러스 단백질 발현 벡터 시스템에 대한 자세한 내용은 벡터 가이드를 참조하세요.
Figure 1. 배큘로바이러스-곤충 재조합 단백질 발현 벡터의 맵.
사례 연구
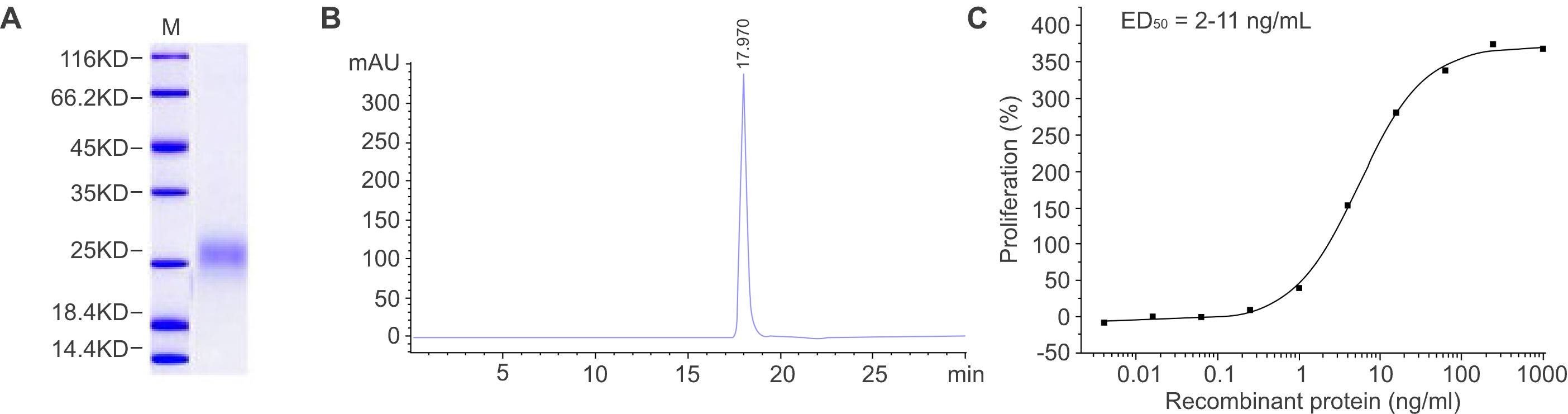
Figure 2. 곤충 세포에서 생산된 재조합 단백질의 특성 분석. (A) SDS-PAGE 분석은 재조합 단백질의 분자 질량을 보여주며 순도는 ≥ 95%로 결정되었습니다. (B) 순도는 SEC-HPLC에 의해 ≥ 95%로 결정되었습니다. (C) 재조합 단백질의 생물학적 활성은 세포 증식 분석을 통해 측정되었습니다. ED50 은 2~11 ng/ml입니다.
주문 방법
고객이 제공하는 벡터
고객이 제공하는 시료가 필요한 경우 시료 제출 가이드라인에 따라 준비하여 VectorBuilder로 보내주십시오. 시료의 배송 지연이나 손상을 방지하기 위해 당사의 가이드라인을 엄격히 따라 시료를 준비해 주시기 바랍니다. 고객이 제공하는 모든 시료는 VectorBuilder의 필수 QC를 거치며, 각 항목에 대해 $100의 추가 요금이 부과될 수 있습니다. 고객이 제공한 시료가 QC를 통과해야만 생산을 시작할 수 있습니다.
FAQ
프로젝트에 가장 적합한 시스템을 선택할 때 모든 재조합 단백질 발현 시스템은 고려해야할 장단점이 있습니다. 아래 표에는 각 시스템의 장단점이 요약되어 있습니다.
| Recombinant protein expression system | Pros | Cons |
|---|---|---|
| Bacteria |
|
|
| Mammalian cells |
|
|
| Insect |
|
|
| Cell-free system |
|
|
태그는 재조합 단백질 생산에 자주 활용됩니다. 태그는 정제 과정을 간소화하고, 특정 태그에서는 단백질 용해도, 수율 또는 순도가 향상되는 것으로 나타났습니다. Protease 절단 부위에 태그가 부착되어 있으면 정제 후 제거가 가능하며, 목적 단백질에 따라 절단 효율이 달라집니다. 적절한 태그를 신중하게 선택하는 것은 다운스트림 단백질 발현 및 정제에 매우 중요합니다. 아래 표에는 일반적으로 사용되는 태그의 개요와 장점 및 제한사항이 정리되었습니다.
| Tag | Commonly applied system | Advantages | Limitations |
|---|---|---|---|
| GST | Bacteria, insect |
|
|
| His | All |
|
|
| SUMO | Bacteria, insect |
|
|
| Flag | Mammalian cells, insect |
|
|
| MBP | Bacteria, insect |
|
|
| Fc | Mammalian cells, insect |
|
|
For more information regarding tags, please visit protein tags.
Fall armyworm Spodoptera frugiperda에서 유래한 Sf9 및 Sf21 세포와 cabbage looper Trichoplusia ni에서 유래한 Hi-5 세포는 배쿨로바이러스 생성 및 재조합 단백질 발현을 위해 가장 널리 사용되는 곤충 세포주입니다. 아래 표는 각 세포주의 특성을 요약한 것입니다.
| Hi-5 | SF9, SF21 |
|---|---|
|
|