헤르페스단순포진바이러스 Herpes Simplex Virus (HSV)
재조합 herpes simplex virus (HSV)는 최근 유전자 치료 및 암 치료에 있어서 신경계로의 유전자전달, 종양 용해제, 암, HSV 및 다른 전염병에 대한 백신 개발을 포함하여 다양한 응용 분야에서 유망한 바이러스 벡터로 부상했습니다. HSV 벡터는 자연적인 향신경성, 숙주 세포의 일생 동안 episomal하게 잠복 상태를 유지하는 능력, 큰 유전자 운반 능력과 같은 몇 가지 장점이 있습니다. 이러한 특징으로 인해 다양한 in vitro 및 in vivo 유전자전달을 위한 이상적인 바이러스 매개체가 됩니다.
VectorBuilder는 replication-defective amplicons 뿐만 아니라 야생형 및 attenuated 바이러스를 포함하여 살아있는 바이러스를 재구성하는데 사용할 수 있는 HSV 벡터의 디자인 및 제작을 전문으로 합니다. 또한 research-grade 및 GMP-grade HSV 패키징 서비스를 제공합니다.
제공되는 HSV 서비스 유형
VectorBuilder는 다음과 같은 HSV 서비스를 제공합니다.
- BAC 또는 BAC YAC 백본에서 HSV 벡터 클로닝
- HSV-1 바이러스 패키징
- HSV-1 amplicon 벡터 클로닝
서비스 세부 사항
HSV BACYAC 벡터
VectorBuilder는 HSV 벡터 클로닝를 위한 자체의 "BACYAC" backbone을 개발했습니다. 이 backbone은 bacterial artificial chromosome (BAC)과 yeast artificial chromosome (YAC)의 핵심 요소를 결합하였습니다. Backbone의 BAC 요소는 벡터가 BAC처럼 행동하고 E. coli에서 증식할 수 있게 해주며, YAC 요소는 벡터가 YAC처럼 행동하고 효모 Saccharomyces cerevisiae에서 증식할 수 있도록 해줍니다. 따라서 BACYAC backbone은 사용자에게 E. coli 또는 효모에서 벡터를 증식하고 변형할 수 있는 유연성을 제공합니다.
BACYAC backbone은 LacZ 또는 EGFP 리포터와 함께 사용할 수 있어서 리포터 발현에 의하여 감염된 세포를 쉽게 식별할 수 있습니다. 이 backbone은 최종 바이러스 유전체에서 Cre-mediated recombination에 의해 backbone이 쉽게 제거될 수 있도록 하기 위한 loxP 부위가 backbone의 양쪽에 있습니다.
HSV BACYAC 벡터의 기본 디자인은 아래 Figure 1에 나와 있습니다.
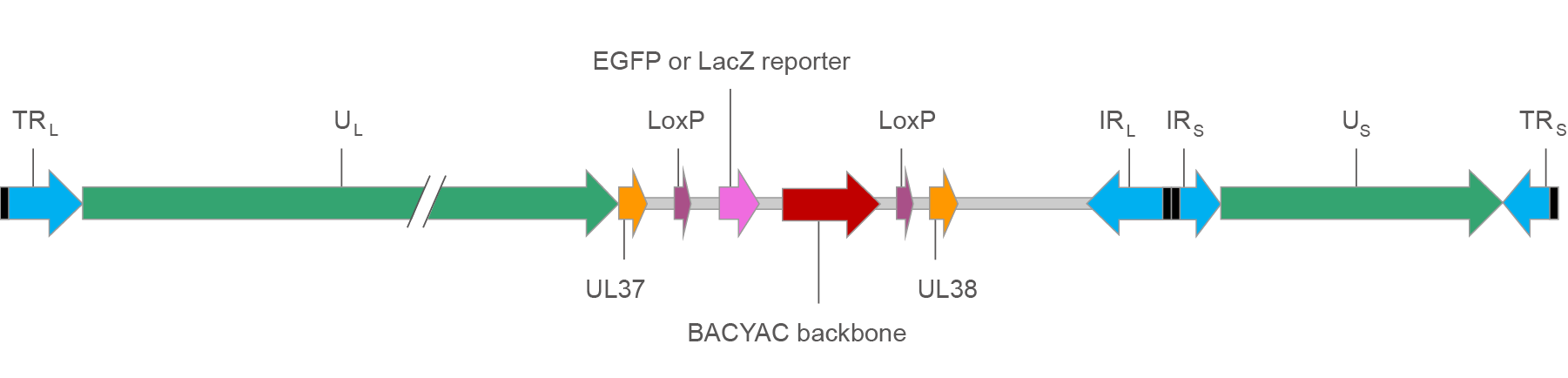
Figure 1. EGFP 또는 LacZ reporter를 가진 HSV BACYAC의 Map.
TRL/IRL: Unique long segment (UL) 양쪽의 terminal 및 inverted repeat region들. 양쪽에 ‘a’ 서열 (black boxes)에 의한 경계가 있으며, 여기에서 4 isomer들을 형성하기 위한 재조합이 일어납니다.
TRS/IRS: Unique short segment (US) 양쪽의 terminal 및 inverted repeat region들. 양쪽에 ‘a’ 서열 (black boxes)에 의한 경계가 있으며, 여기에서 4 isomer들을 형성하기 위한 재조합이 일어납니다.
UL/US: HSV 유전자를 인코딩하는 Unique long segment 및 unique short segment.
UL37/UL38: HSV UL37 및 UL38 유전자들. 외래 DNA를 UL37과 UL38 사이에 삽입하면 HSV의 독성에 작은 변화가 일어나게 됩니다.
LoxP: Cre recombinase를 위한 재조합 부위. Cre가 존재하면 같은 방향으로 배치된 두 개의 loxP 부위들 사이의 서열은 잘려져 제거됩니다.
EGFP 또는 LacZ reporter: CMV promoter에 의하여 발현되는 EGFP 또는 LacZ 리포터. 리포터 발현에 의하여 감염된 세포를 쉽게 식별할 수 있습니다.
BACYAC backbone: Bacterial artificial chromosome (BAC) 및 yeast artificial chromosome (YAC) backbone. E. coli에서는 chloramphenicol 내성유전자를 이용하여, Saccharomyces cerevisiae에서는 His3 auxotrophic 선별 마커를 이용하여 선별적으로 증식될 수 있게 합니다.
당사의 HSV BACYAC 벡터는 HSV-1 (strains 17, F and KOS) 및 HSV-2 (strain HG52)의 야생형 균주를 포함합니다. 또한 당사의 모든 HSV 벡터 또는 고객이 제공한 HSV 벡터에 BAC recombineering을 통해 변이 서비스 (point mutation, deletion 또는 insertion)를 제공합니다. 바이러스 복제에 필수적인 유전자에 deletion/mutation된 HSV 유전체을 포함하는 BAC은 replication-defective HSV를 생성하는데 사용할 수 있으며, 필수적이지 않은 유전자에 deletion/mutation이 있는 HSV 유전체을 포함하는 BAC은 attenuated HSV를 생성하는데 사용할 수 있습니다.
HSV 바이러스 패키징
가격 및 소요 시간 Price Match
| Scale | Application | Titer | Volume | Price (USD) | Turnaround |
|---|---|---|---|---|---|
| Ultra-purified pilot | Cell culture & in vivo | >107 PFU/ml | 1 ml (10x100 ul) | $2,099 | 28-35 days |
| Ultra-purified medium | >108 PFU/ml | $3,099 |
배송 및 보관
Our HSV is stored in HBSS buffer and is shipped on dry ice. Upon receiving, it should be stored at -80°C for long term (stable for at least 6 months), or -20°C for use within one week. The shelf life for HSV is approximately one year. Please avoid repeated freeze-thaw cycles of HSV, as this can result in a large titer drop.
HSV amplicon 벡터
VectorBuilder는 최소한의 바이러스 서열, 즉 origin of replication (oriS) 및 패키징 서열 (pac)과 하나 이상의 관심 유전자를 포함하는 HSV-1 amplicon plasmid를 제공합니다. Amplicon plasmid는 바이러스 패키징 signals을 제외한 전체 HSV-1 유전체를 포함하는 BAC의 형태로 제공될 수 있는 helper에 의하여, 감염은 되지만 replication은 되지 않는 바이러스 입자로 패키징 될 수 있습니다.
HSV-1 amplicon plasmid의 기본 디자인은 아래의 Figure 2에 나와 있습니다.
Figure 2. HSV-1 amplicon plasmid Map.
Promoter: 발현할 유전자 (GOI)를 위한 promoter의 위치입니다.
Kozak: Kozak consensus 서열. 진핵생물의 translation 시작을 촉진하는 것으로 알려진 서열로 GOI ORF의 start codon 앞에 위치합니다.
ORF: GOI의 open reading frame이 여기에 위치합니다.
BGH pA: Bovine growth hormone polyadenylation. Upstream ORF의 transcriptional termination을 촉진합니다.
HSV-1 pac: Herpes simplex virus 1 패키징 signal. 바이러스 DNA가 바이러스로 패키징될 때 필요합니다.
Ampicillin: Ampicillin 내성 유전자. Plasmid가 ampicillin 선별에 의하여 E. coli 내에서 유지되도록 해줍니다.
pUC ori: pUC origin of replication. 이 origin을 가진 plasmid는 E. coli 내에서 높은 copy 수로 존재합니다.
oriS: HSV-1 origin of DNA replication. Plasmid가 concatemeric DNA로 증폭되고 HSV-1 입자로 패키징되도록 해줍니다.
IE4/5: HSV-1 ICP22 및 ICP47 immediate early gene promoter. Promoter의 활성은 HSV-1 tegument protein VP16과의 상호작용에 의해 결정됩니다. Downstream marker 유전자가 보편적으로 발현되도록 하며, 또한 oriS stimulating origin function의 transcription 조절 서열로도 작용합니다.
Marker: 감지될 수 있는 유전자 (EGFP, LacZ, 등). 벡터로 transduction된 세포가 시각적으로 관찰될 수 있도록 해줍니다.
SV40 early pA: Simian virus 40 early polyadenylation signal. Upstream ORF의 transcriptional termination을 촉진합니다.
기술적인 정보
HSV 생산 및 QC
HSV 패키징(Figure 3)의 경우 관심 유전자(GOI)를 포함하는 BACYAC plasmid가 Cre plasmid와 함께 패키징 세포로 transfection됩니다. 그런 다음 BACYAC 백본이 제거된 것에서 바이러스를 정제하기 위해 nonfluorescent plaque를 선택합니다. 그런 다음 선택한 plaque를 새로운 디쉬에 적용하여 HSV를 증폭합니다. Ultra-purified HSV의 경우, 바이러스 입자는 sucrose density gradient centrifugation에 의해 추가로 정제되고 농축됩니다.
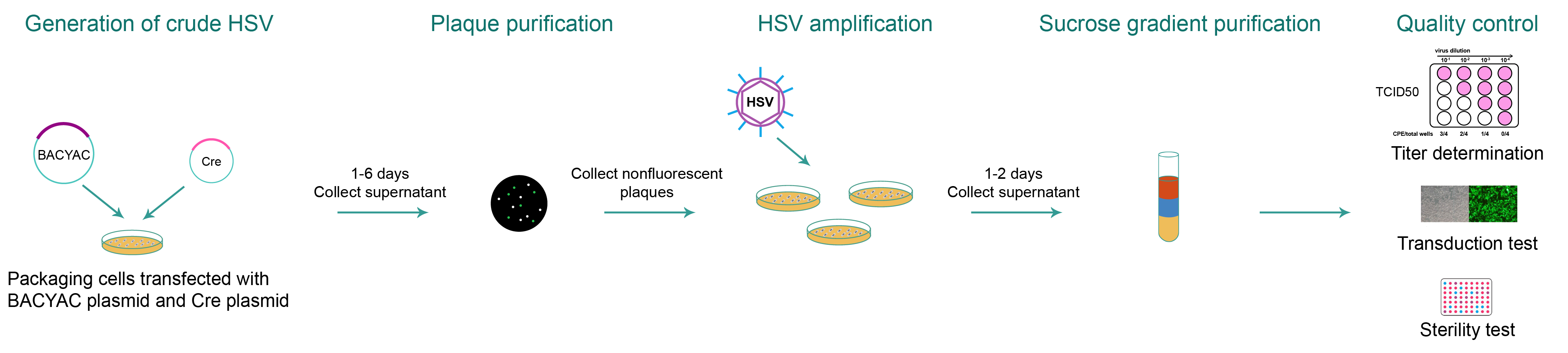
Figure 3. BACYAC 백본이 제거된 BACYAC 벡터에서 HSV 패키징의 일반적인 워크플로우.
VectorBuilder에서 생산된 각 재조합 HSV에 대해 품질 관리에는 titer 측정, 박테리아 및 곰팡이에 대한 무균 테스트, mycoplasma 검출이 포함됩니다. HSV 벡터가 형광 단백질을 인코딩하는 경우 해당 형광을 검출하기 위해 transduction 테스트를 수행합니다. HSV 벡터가 drug-selectable 마커를 인코딩하는 경우 transduction 테스트를 수행한 후 해당 drug selection을 수행합니다. 또한, ultra-purified HSV의 경우 일상적으로 endotoxin assay를 수행하여 endotoxin 레벨을 확인합니다.
실험적인 검증
당사의 HSV 벡터를 사용하여 활성을 가진 바이러스를 생산할 수 있음을 확인하였습니다. BACYAC 벡터를 사용하여 야생형 HSV 바이러스 입자를 성공적인 패키징한 후 표적 세포로 transduction한 예를 아래의 Figure 4와 Figure 5에 보여주고 있습니다.
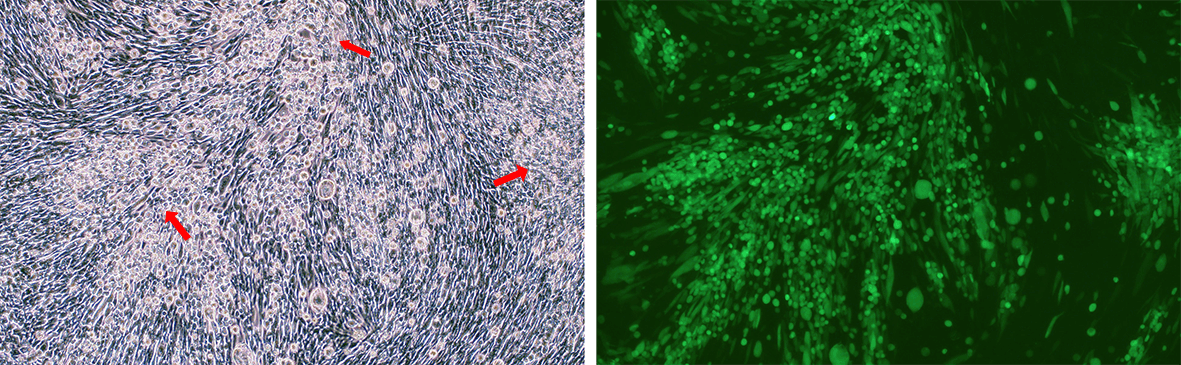
Figure 4. BHK21 세포를 전체 유전체 서열과 EGFP reporter를 가진 야생형 HSV-1 (KOS strain) 을 가진 BACYAC 벡터로 transfection 하였습니다. 이미지는 transfection 72시간 후의 결과입니다. 죽어가는 세포들로 형성된 원형이면서 빛의 굴절이 증가한 (red arrow) 세포 응집체들에 의해 보여지는 세포변성효과는 살아 있는 바이러스의 존재를 보여줍니다. 배율: 100x.
왼쪽: bright field. 오른쪽: GFP.
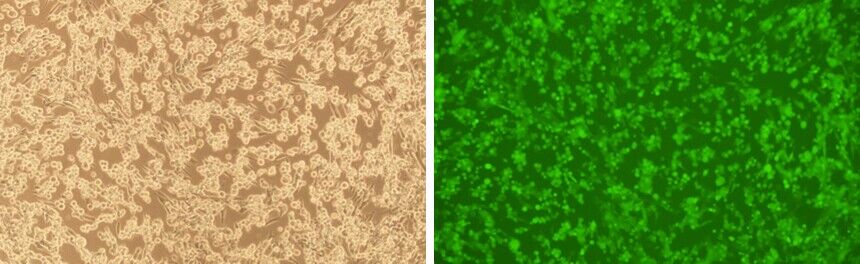
Figure 5. BHK21 세포를 전체 유전체 서열과 EGFP reporter를 가진 야생형 HSV-1 (KOS strain) 을 가진 BACYAC 벡터로부터 만들어진 HSV 입자로 transduction 하였습니다. 이미지는 transduction 96시간 후의 결과입니다. 배율: 100x. 왼쪽: bright field. 오른쪽: GFP.
유전자 치료를 위한 HSV의 장점
HSV는 여러 가지 장점이 있는 envelope을 가진 double strand DNA 바이러스로, HSV 벡터는 유전자 치료에 있어서 관심을 끌고 있는 후보군입니다. HSV 벡터가 제공하는 주요 장점은 다음과 같습니다.
Broad tropism: 넓은 범위의 세포분열을 하거나 하지 않는 세포에 대하여 HSV 벡터가 쉽게 transduction될 수 있습니다. 또한, HSV는 자연적으로 향신경성이며, retrograde axonal transport에 의하여 접종 부위에서 멀리 떨어진 뉴런에 매우 효율적인 유전자 전달을 할 수 있는 능력이 있습니다. 따라서 HSV 벡터는 특정한 신경 질환 치료에 이상적입니다.
Latent behavior: HSV는 감지될 수 있는 부작용없이 감각 뉴런 내의 잠복 상태를 무기한으로 유지할 수 있는 능력이 있습니다. 이러한 잠복 상태를 지속하는 능력은 HSV가 숙주의 면역체계를 회피하고 일생 동안 숙주 세포 내에서 지속되도록 합니다. 이는 장기간의 발현이 필요한 연구를 위해서 HSV 벡터를 사용할 때 뉴런에서 관심 유전자를 안정적으로 발현할 수 있다는 장점이 됩니다.
Minimal risk of insertional mutagenesis: 잠복 감염 상태를 유지할 때, HSV는 숙주 유전체에 결합하지 않고 episome 상태를 유지하기 때문에 외래 DNA에 의한 숙주 유전체의 삽입에 의한 변이 유발 위험을 최소화합니다.
Ability to grow in tissue culture: HSV는 조직 배양에 의하여 매우 쉽게 배양할 수 있으며, 다양한 동물 모델에서 잠복 감염을 확립하는 것으로 나타났습니다.
High viral titer: HSV 벡터는 높은 titer의 바이러스로 패키징될 수 있기 때문에 타겟 세포를 고효율로 transduction 할 수 있습니다.
Large cargo capacity: HSV는 80개 이상의 유전자를 포함하는 큰 유전체를 가지고 있으며, 그중 일부는 복제에 필수적이지 않습니다. HSV의 이러한 특성은 이 필요없는 유전자들을 제거하여 긴 서열 또는 여러 개의 transgene들을 발현하기 위한 사용 가능한 공간으로 활용할 수 있도록 해주는 유연성을 제공합니다.
일반적으로 사용되는 HSV 벡터
HSV 벡터는 크게 다음과 같은 범주로 분류될 수 있습니다.
HSV BAC 벡터
HSV BAC은 바이러스 증식을 허용하는 진핵 세포에서 homologous recombination을 통해 BAC backbone 서열을 HSV 유전체에 삽입하여 만들어집니다. EGFP와 같은 선별 마커는 BAC 서열을 성공적으로 결합한 재조합 바이러스를 정제하는데 도움이 됩니다. Herpesvirus 유전체는 숙주 세포 핵에서 복제되는 과정에서 원형화된 중간체를 형성하며, 이는 이후 E. coli에 형질전환하기 위해 분리됩니다. BAC backbone에 존재하는항생제 내성 유전자는 바이러스 BAC를 가진 박테리아 세포의 선별을 용이하게 합니다. 마지막 단계는 박테리아 세포에서 바이러스 BAC DNA를 분리하여, 제한효소 처리 및 시퀀싱 분석을 통해 온전함을 검증합니다. 일단 검증이 되면 HSV BAC은 바이러스 증식이 가능한 진핵 숙주세포에 transfection되어 살아있는 바이러스를 생성합니다.
HSV는 유전체의 크기가 크기 때문에, HSV를 클로닝하기 위해 일반 plasmid 벡터를 사용하는 것은 불가능합니다. 반면에 BAC은 큰 DNA 서열을 운반하는 능력과 느린 복제율로 인해 HSV 생물학 연구에 선호되는 벡터입니다. HSV BAC은 임상적으로 분리된 바이러스를 바이러스 증식을 허용하는 세포에서 증식하는 것과 비교할 때, E. coli 에서 BAC 으로 유지하는 것이 바이러스 서열이 더 안정하게 유지될 수 있도록 해줍니다. 또한 HSV BAC은 일반적인 유전공학 기술을 사용하여 바이러스 유전체를 매우 쉽고 정확하게 조작할 수 있기 때문에 원하는 변이 바이러스를 생성할 수 있는 유연성을 제공합니다.
HSV BAC은 위에서 언급한 여러 가지 장점을 제공하지만 고려해야 할 몇 가지 제한사항이 있습니다. HSV BAC은 바이러스 유전체 내에 존재하는 반복적인 서열의 불안정성으로 인해 원하지 않는 변이가 생겼는지 주기적으로 확인해야 합니다. 또한, 바이러스 유전체 내에 포함된 BAC backbone으로 인해 바이러스 유전체의 크기가 커지면서 바이러스의 증식을 방해할 수 있는 것으로 밝혀졌습니다. 따라서 HSV BAC을 디자인할 때 BAC backbone 양쪽에 loxP 또는 FRT 사이트를 포함하여 각각 Cre 또는 Flp에 의한 재조합으로 BAC backbone을 제거할 수 있도록 하는 것이 바람직합니다.
HSV amplicon 벡터
Amplicon은 최소한의 바이러스 서열 외에 하나 이상의 관심유전자 (GOI) 를 포함하는 HSV-1 기반의 plasmid이며, HSV-1 helper 바이러스나 클로닝된 HSV-1 유전체가 helper로 존재할 때 살아있는 HSV 입자로 패키징될 수 있습니다. Amplicon은 바이러스에서 유래된 것으로는 두가지 서열만을 포함하며, 이들은 패키징 세포에서 바이러스 복제를 허용하는 oriS로 알려진 origin of replication과 살아있는 바이러스로의 패키징을 용이하게 하는 pac으로 알려진 패키징 서열들입니다. HSV 입자는 amplicon plasmid의 tandem repeat로 구성된 head-to-tail concatemer를 생성함으로써 야생형 HSV-1에서 사용되는 것과 유사한 rolling-circle 메커니즘에 의해 amplicon 유전체를 복제함으로써 생성됩니다.
Amplicon 벡터는 최대 150kb의 긴 서열을 운반할 수 있고, 쉽게 클로닝할 수 있으며, 다양한 세포 유형을 transduction할 수 있는 능력 및 높은 transduction 효율 등의 유전자 전달 도구로서의 장점을 제공합니다. 또한, 바이러스 단백질을 인코딩하는 서열이 없기 때문에 transduction한 세포와 생물체에 대한 독성과 병원성이 전혀 없으며, 숙주 세포 내의 잠복하여 존재할 수 있는 바이러스 유전체와 작용하여 활성화시키거나 재조합할 가능성을 최소화할 수 있습니다.
오랫동안 amplicon 기반 유전자 전달의 주요 한계는 helper 바이러스가 없는 높은 titer의 amplicon 벡터 stock을 생성하는 것이었습니다. helper 바이러스로 오염된 amplicon stock은 잠재적인 세포 독성 및 염증 반응을 유발할 수 있으므로 유전자 치료에 적합하지 않습니다. Helper의 기능을 제공하기 위해 바이러스 패키징 시그널만을 제외한 전체 HSV-1 게놈을 포함하는 중복된 cosmid 또는 BAC 벡터들을 활용하는 helper 바이러스가 없는 패키징 시스템을 개발함으로써 이 문제는 상당부분 극복이 되었습니다. 이 방법은 helper 바이러스가 거의 없는 amplicon stock을 생성할 수 있지만, 높은 바이러스 titer를 얻을 수 없다는 제약이 있습니다. Helper 바이러스의 오염을 최소화하면서 높은 titer의 amplicon stock을 얻기 위한 대안으로 Cre-lox 기술을 사용하여 바이러스를 생성하는 세포에서 helper 바이러스의 패키징 시그널을 제거하는 방법이 있습니다. 그러나 이 방법을 사용하여 생산된 amplicon stock은 여전히 매우 낮은 수준의 helper 바이러스로 오염될 수 있으므로 특정 유전자 치료 응용분야에서는 사용이 제한될 수 있습니다.
Replication (복제) 이 결손된 HSV 벡터
복제가 결손된 HSV 벡터는 바이러스 복제에 필수적인 유전자의 결실 또는 변이에 의해 생성됩니다. 복제 결함 HSV는 복제에 필요한 바이러스 단백질이 이를 발현하는 세포주에 의하여 제공될 때만 증식을 할 수 있습니다. 지금까지 보고된 대부분의 복제 결함 HSV 벡터는 ICP0, ICP4, ICP22, ICP27 및 ICP47을 포함한 infected cell protein (ICP)을 인코딩하는 immediate-early (IE) 유전자를 다양한 조합으로 제거함으로써 생성되었습니다. ICP는 각각 바이러스 유전체 복제 및 virion 구조의 조립에 필수적인 단백질들을 인코딩하는 일련의 early (E) 및 late (L) 바이러스 유전자의 전사를 시작하기 위해 HSV가 숙주 세포에 들어간 직후 발현됩니다. 따라서 IE 유전자의 결실은 초기 및 후기 바이러스 유전자들의 발현을 억제합니다.
복제 결함 HSV 벡터의 최신 버전은 복수의 IE 유전자의 결실에 의해 생성되었으며, 이 벡터는 더 적은 수의 IE 유전자의 결실에 의해 생성된 이전 버전에 비해 세포에 대한 독성이 훨씬 더 작습니다. 이러한 벡터에서 일부 비필수 유전자와 함께 여러 필수 유전자의 제거는 벡터의 유전자 운반능력을 증가시켜 여러 개의 독립적인 유전자 발현 카세트를 발현하는데 사용할 수 있는 이점을 제공합니다. 따라서 이러한 벡터는 여러 개의 transgene을 동시에 발현할 필요가 있는 유전자 치료 분야에 매우 적합합니다.
복제 결함 HSV 벡터의 주요한 단점은 단일 IE 유전자의 결실에 의해 생성된 벡터들에서 관찰되는 세포에 대한 독성입니다. 5개의 IE 유전자 모두를 제거한 벡터는 세포에 대한 독성 문제를 상당히 줄일 수 있지만, 이러한 벡터는 세포 배양에서 증식이 잘 안되고 transgene 발현 수준이 감소하는 것으로 나타났습니다. 따라서 복제 결함 HSV 벡터의 최적 성능을 위해서는 올바른 조합으로 필수적인 유전자들을 제거하는 일이 매우 중요합니다. 복제 결함 HSV 벡터의 다른 단점은 이러한 벡터의 증식이 결여된 바이러스 단백질을 공급할 수 있는 세포주에 대한 큰 의존성을 갖는다는 점입니다.
Attenuated (독성이 약화된) HSV 벡터
Attenuated HSV 벡터 (conditional replicating HSV 벡터라고도 함)는 in vivo에서 바이러스-숙주 상호 작용의 다양한 측면에 관여하는 유전자들처럼 in vitro에서 바이러스 복제에 필수적이지 않은 유전자의 결실 또는 변이에 의해 생성됩니다. 따라서 attenuated HSV는 세포 배양에서는 복제할 수 있지만, in vivo의 특정 조건에서는 복제할 수 없습니다. 이와 같은 특성을 이용하여 정상 세포에서는 복제할 수 없지만 종양 세포에서는 선택적으로 복제할 수 있는 여러 attenuated HSV 벡터가 종양용해제로 개발되고 있습니다.
복제가 안되는 HSV 벡터에 비하여 attenuated HSV 벡터는 복제하고 감염을 쉽게 확산할 수 있는 능력으로 인해 훨씬 더 효율적으로 유전자 전달을 할 수 있는 이점을 제공합니다. 또한 attenuated HSV 벡터를 바이러스 백신으로 사용하면 숙주의 면역 체계가 모든 바이러스 항원에 노출될 수 있는 기회를 제공하여, 세포성 면역 및 체액성 면역을 모두 자극할 수 있습니다. 더욱이, 이러한 벡터는 상대적으로 쉽게 세포 배양에서 증식할 수 있으므로 백신 개발을 위한 비용적인 효율성을 제공합니다.
Attenuated HSV 벡터의 주요한 제한은 복제 능력으로 인해 발생할 수 있는 여러 가지 잠재적인 안전 문제입니다. Attenuated HSV 벡터와 관련된 위험에는 복제하는 바이러스가 in vivo에서 변이나 재조합에 의하여 더 큰 병원성을 갖는 바이러스로 변이될 가능성, 바이러스 또는 변이 바이러스가 환자로부터 다른 사람에게로 퍼질 가능성, 바이러스 또는 변이 바이러스가 환자 또는 태아에게 병원성을 나타내게 될 가능성 등이 있습니다. Attenuated 벡터의 또 다른 단점은 바이러스를 과도하게 약화시켜 그 효과를 크게 감소시킬 수 있다는 점입니다. 따라서 원하는 기능을 가진 attenuated 벡터를 만들기 위해서는 제거되거나 변이될 유전자들을 신중하게 선택하는 것이 매우 중요합니다.
HSV 벡터의 주요 용도
재조합 HSV 벡터는 다양한 유전자치료 응용분야에 사용됩니다. 다음은 HSV 벡터가 광범위하게 사용되고 있는 주요 연구 분야입니다.
종양용해제로서의 HSV 벡터
여러 가지 요인으로 인해 HSV-1 벡터가 종양용해 바이러스 치료법을 위한 매력적인 후보가 되게 합니다. HSV-1은 감염성이 매우 높아 10시간 만에 전체 복제주기를 완료하여 수천 개의 progeny virion을 방출하는데, 이는 adenovirus와 같은 다른 일반적인 바이러스에 비해 훨씬 더 빠릅니다. HSV-1 virions은 세포외 확산 이외에도 세포들 사이의 junction을 통해 한 세포에서 다른 세포로 확산될 수 있어 고형 종양 내에서 매우 효율적인 바이러스 확산이 가능합니다. 또한 HSV-1은 다양한 실험실 동물들을 효과적으로 감염시키는 것으로 밝혀져 in vivo 전임상 연구에 매우 적합합니다.
암세포에서 선택적으로 복제하고 암세포를 죽이도록 디자인된 attenuated HSV 벡터는 종양용해 바이러스로 널리 사용되고 있습니다. 이러한 벡터는 정상 세포에서 바이러스 복제에 필수적이지만 종양 세포에는 필수적이지 않은 유전자를 제거하여 생성할 수 있습니다. 이러한 벡터의 항종양 효과는 항종양이거나 화학치료제를 활성화할 수 있는 유전자를 전달하도록 변형함으로써 더욱 향상될 수 있습니다. 현재 흑색종 치료에 사용되는 FDA 승인 약물인 Talimogene Laherparepvec (TVEC)는 종양용해 잠재력이 있는 attenuated HSV-1 벡터의 예입니다. TVEC는 각각 정상 세포에서 바이러스 복제를 억제하고 면역 체계를 활성화시키는 바이러스 유전자 ICP34.5 및 ICP47을 제거하여 HSV-1에서 파생되었습니다. TVEC의 종양용해 잠재력은, 수지상 세포 (dendritic cell) 의 이동 및 성숙을 촉진하여 면역 시스템을 더욱 자극하는human granulocyte-macrophage colony-stimulating factor (GM-CSF)를 인코딩하는 유전자의 과발현에 의해 더욱 증가됩니다.
Attenuated 벡터 외에도 복제 결함 HSV 벡터도 다양한 암 치료에 널리 사용되어 왔습니다. 이러한 접근법은 주로 thymidine kinase (TK)와 같은 자살 유전자 또는 종양 세포 내에서 TNF-α와 같은 치료 잠재력을 가진 유전자를 단독으로 또는 조합하여 발현하는 복제 결함 HSV를 주로 활용하고 있습니다.
백신으로서의 HSV 벡터
HSV 벡터는 다음과 같은 바이러스 및 박테리아 병원체에 대한 바이러스 백신으로 사용될 수 있는 여러 가지 장점을 제공합니다. 1) 다양한 경로를 통한 접종에 대한 반응으로 숙주 생물에서 강력한 면역 반응을 유도하는 능력; 2) 숙주 세포의 유전체에 결합하지 않고, 숙주 세포 핵에서 episome으로 지속적으로 유지되는 능력; 3) ganciclovir와 같은 비독성 약물을 세포독성 대사산물로 전환하는 능력을 가져서 원치 않는 효과가 발생할 경우 바이러스에 감염된 세포를 죽이는데 사용될 수 있는 TK 유전자가 HSV 유전체에 자연적으로 존재한다는 점 등입니다. HSV-BAC, amplicon 벡터, 복제 결함 HSV 벡터 및 attenuated HSV를 사용한 연구는 모두 다양한 병원체에 대한 바이러스 백신으로 사용될 때 유망한 결과를 보여주었습니다.
Attenuated HSV 벡터는 숙주의 면역 시스템이 모든 바이러스 항원에 노출될 수 있는 기회를 제공하여 세포성 면역 및 체액성 면역을 모두 자극하기 때문에 anti-HSV 백신 개발에 특히 적합합니다. 또한, attenuated 생백신은 비활성 백신이나 바이러스 유전체의 특정한 일부 서열만 발현하는 백신 벡터에 비해 더 장기적이고 효과적인 방어를 제공하는 것으로 나타났습니다. 세계 인구의 상당한 부분이 HSV-1 및 HSV-2에 감염되어 있고, 현재 이들에 대한 FDA에서 승인된 백신이 없다는 점을 고려할 때, anti-HSV 백신 개발이 절박한 상황입니다. 바이러스 당단백질 gK 및 막단백질 UL20의 부분 결실에 의해 개발된 attenuated 생 HSV-1 벡터인 VC2는 HSV-1 및 HSV-2 감염에 대한 동물 모델에서 테스트했을 때 백신 후보로서 큰 잠재력을 보여주었습니다.
바이러스 복제에 필수적인 유전자가 제거되고 특정한 외래 항원을 발현하는 복제 결함 HSV 돌연변이는 바이러스 및 세포 내 박테리아 감염의 다양한 동물 모델에서 백신으로 투여될 때 지속적이고 강력한 면역 반응을 유도하는 것으로 나타났습니다. 또한, amplicon 벡터는 마우스 모델을 사용한 여러 전임상 연구에서 암, 미생물 감염 및 신경 질환에 대한 치료 백신으로 널리 이용되어 왔습니다. 그러나 기존에 HSV에 대한 면역이 있는 경우를 포함하는 다른 동물 모델에서 면역원성 잠재력을 평가하기 위해서는 추가 연구가 필요합니다.
유전자 전달 운반체로서의 HSV 벡터
HSV amplicon벡터는 신경친화성, 큰 유전자 운반능력 (<150kb), 낮은 독성 및 표적 세포 내에서 episome으로 남아 있는 능력으로 인해 신경세포에 대한 유전자 전달 매개체로 특히 적합합니다. 따라서 다음과 같은 분야의 연구에 널리 사용되어 왔습니다: 1) 알츠하이머 및 파킨슨 병과 같은 신경 퇴행성 질환; 2) 우울증과 중독을 포함한 신경정신 질환; 및 3) 급성 허혈 뇌졸중과 같이 신경계에 치료 유전자를 전달해야 하는 질병의 치료. 또한 다양한 종류의 분열하는 세포를 감염시키는 능력과 plasmid transfection에 비해 상대적으로 쉬운 HSV amplicon 벡터를 사용한 세포 감염 등의 특성에 의해 amplicon 벡터는 in vitro 약리학 연구에 매우 적합합니다.
복제 결함 HSV 벡터는 바이러스 복제에 필수적인 유전자의 결실에 따른 현저히 감소된 세포독성 때문에 유전자 치료를 위한 유전자 전달 매개체로도 사용됩니다. 여러 유전자의 제거에 의하여 이러한 벡터는 큰 유전자 운반능력을 가지게 되어서, 다중 유전자 치료에 사용되는 벡터에 일반적으로 요구되는 여러 개의 독립된 유전자 발현 카세트들을 운반할 수 있습니다. 따라서 복제 결함 벡터는 만성 통증, 파킨슨 병, 척수 손상 및 lysosomal storage disorders 등을 위한 동물 모델에서 유전자 치료 연구에 널리 사용되어 왔습니다. Human preproenkephalin (PENK)을 발현하는 복제 결함 HSV 벡터인 NP2는 통증 치료를 위한 1상 임상 시험에서 유망한 결과를 보여주었습니다.
주문 방법
자료
자주 묻는 질문
HSV는 자연적인 향신경성 바이러스로 amplicon으로 사용될 때는 150 kb까지의 큰 DNA 서열을 포함할 수 있습니다. 또한 숙주 세포의 일생 동안 숙주 내에서 잠복 상태를 유지할 수 있는 능력으로 인해 렌티바이러스, AAV, 아데노바이러스 등과는 다른 고유한 장점을 지니고 있습니다. 그밖에도 감염시킬 수 있는 숙주 세포의 범위가 넓고, 숙주 세포의 유전체 내로 결합하지 않고 episome 상태를 유지할 수 있으며, 세포 배양을 통하여 쉽게 증식되며, 높은 titer의 바이러스로 패키징될 수 있습니다.
VectorBuilder는 HSV BACYAC 벡터와 amplicon 벡터의 형태로 제공하며 둘 다 생 바이러스로 생산될 수 있으며, 당사에서는 이를 검증하기 위한 광범위한 테스트를 진행해왔습니다. HSV BACYAC은 바이러스 생산을 위하여 BHK21세포와 같은 바이러스 증식을 허용하는 진핵 숙주 세포에 transfection됩니다. Aplicon vector는 패키징 기능이 손상된 HSV-1 유전체를 포함하는 BAC을 함께 transfection함으로써 생 바이러스를 생성할 수 있습니다. Figure 4 에서 당사의 벡터를 사용하여 야생형 HSV-1 바이러스 입자를 성공적으로 패키징 할 수 있음을 보여주고 있습니다.
HSV 벡터는 일반적으로 biosafety level-2 (BSL-2) containment에서 사용될 수 있습니다. 하지만 생물안전성에 대한 정책은 기관에 따라 많이 다를 수 있기 때문에, 바이러스 벡터를 사용하는 연구자에게 각자의 기관에서 정한 생물안전성 가이드라인에 따라서 사용해야 할 책임이 있습니다.



