AAV Capsid 진화(AAV Capsid Evolution)
재조합 아데노부속바이러스 (adeno-associated virus, AAV)는 넓은 tropism, transgene의 장기적 발현, 비병원성 및 낮은 면역원성 때문에 광범위한 유전자 치료 및 백신 등의 응용 분야에서 널리 사용되는 유전자 전달 벡터입니다.
그러나 기존 AAV serotype의 몇가지 문제는 치료제로서의 AAV의 잠재력을 제한합니다. 첫째, 현존하는 serotype들은 선택할 수 있는 다양한 tropism을 제공하지만, 많은 임상 응용에는 기존 AAV serotype들이 제공하는 것 이상의 조직 특이성이 요구됩니다. 둘째, 치료 대상 조직에 대하여 하나 이상의 AAV serotype에 의하여 tropism을 제공하더라도, 유전자 전달 효율이 너무 낮을 수 있고 off-target 조직에 대해 바람직하지 않은 tropism이 있을 수도 있습니다. 셋째, 많은 기존의 AAV serotype들에 대한 중화 항체는 초기 또는 반복되는 바이러스 투여시에 바이러스의 효율적인 전달을 차단할 수도 있습니다. 마지막으로, 일부 serotype들은 본질적으로 높은 titer, 순도 및 안정성으로 제조하기가 어렵습니다. 이러한 한계를 극복하기 위해 AAV capsid engineering은 개선된 기능을 갖춘 새로운 AAV variant들의 개발을 가속화하는 중요한 연구 영역이 되어오고 있습니다.
Directed evolution은 향상된 생체 분자를 engineering하기 위해 널리 사용되는 high-throughput에 의한 방식입니다. 이는 반복되는 유전적 다양화와 선택을 통해 자연선택의 과정을 모방합니다. AAV capsid의 directed evolution은 야생형 AAV capsid 유전자에 변이를 도입하여 매우 다양한 서열을 가진 AAV capsid library를 생성하고, 그런 다음 이를 스크리닝하여 개선된 특성을 갖는 새로운 capsid variants를 찾아냅니다. Directed evolution은 단백질의 구조-기능 관계에 대한 사전 지식을 필요로 하지 않기 때문에, AAV capsid engineering을 위하여 rational design보다 선호되는 경우가 많습니다.
서비스 중점 사항
- 전체적인 서비스 플랫폼: VectorBuilder는 모든 AAV 전임상, 임상 CRO 및 CDMO의 수요에 대한 원스톱 솔루션을 제공할 수 있는 세계 유일의 회사입니다. AAV 서비스에는 vector 디자인 및 최적화, vector 클로닝, library 제작, 바이러스 패키징, capsid evolution 및 targeted engineering, AAV 생체내 분포 분석 및 GMP 제조가 포함됩니다.
- 다양한 방법에 의한 높은 복잡도를 갖는 capsid library 제작: 당사의 Pooled library 제작에 대한 광범위한 전문 지식에 의하여 mutagenesis 또는 combinatorial approach를 통해 매우 다양한 capsid library를 디자인하고 맞춤형 제작이 가능하도록 고객을 지원합니다.
- 높은 titer의 capsid library 바이러스 패키징: Capsid library의 one-step또는 two-step 바이러스 패키징을 수행하여 각 바이러스 입자가 유전체에 해당 capsid variant를 포함하도록 하고 높은 바이러스 titer를 얻을 수 있도록 합니다.
- 비인간 영장류 (NHP) 를 포함한 다양한 종에서 하는 in vivo screening 제공: in vitro screening 외에도 mouse, rat, 그리고 중요하게는 두가지 비인간 영장류 종인 crab-eating macaque (Macaca fascicularis; cynomolgus monkey라고도 함) 및 rhesus macaque (Macaca Mulatta)과 같은 다양한 종을 포함하는 in vivo screening 플랫폼을 제공합니다. In vivo screening은 고도로 훈련된 전문가에 의해 AAALAC 인증 시설에서 수행됩니다.
- 전체적인 기술 지원: 경험이 풍부한 당사의 과학자들은 library 제작에서 in vivo screening, library 디자인에서 NGS 분석에 이르기까지 AAV capsid 프로젝트의 모든 단계를 포함하는 포괄적인 기술 지원을 제공할 수 있습니다.
Capsid Evolution 및 Screening의 워크플로우
AAV capsid evolution의 전체 워크플로우에서 첫번째이자 가장 중요한 단계는 각각의 plasmid가 rep 유전자와 변이 cap 유전자로 구성된 chimeric AAV 유전체를 가지는 매우 다양한 AAV capsid library를 생성하는 것입니다. Capsid 유전자 변이체는 error-prone PCR, random peptide display, DNA family shuffling 또는 in silico design과 같은 다양한 방법을 사용하여 효율적으로 생성할 수 있습니다. 그런 다음 capsid library를 바이러스 입자로 패키징하고, 각 바이러스 입자는 유전체에 해당 capsid 변이체를 가지게 됩니다. 그 다음에 바이러스 library는 chimeric AAV의 능력을 테스트하기 위한 다음과 같은 screening 과정을 거칩니다: 1) 특정 조직이나 기관 내에서 타겟 세포를 효율적으로 transduction하는지, 2) 세포 유형에 따라 특이적인 수용체에 높은 친화력으로 결합하는지, 3) 중화 항체를 회피하는지를 테스트합니다. Screening을 통과한 바이러스 유전체는 타겟 세포에서 회수되어 2차 screening을 위해 더 작은 library로 만들어집니다. 높은 신뢰도를 갖는 변이의 수가 강화되도록 하기 위해 일반적으로 여러 차례의 screening이 수행됩니다. 이로부터 얻어진 변이들은 향상된 특성을 갖는 새로운 AAV capsid 변이체를 찾기 위해 확인하는 과정들을 거치게 됩니다 (Figure 1).
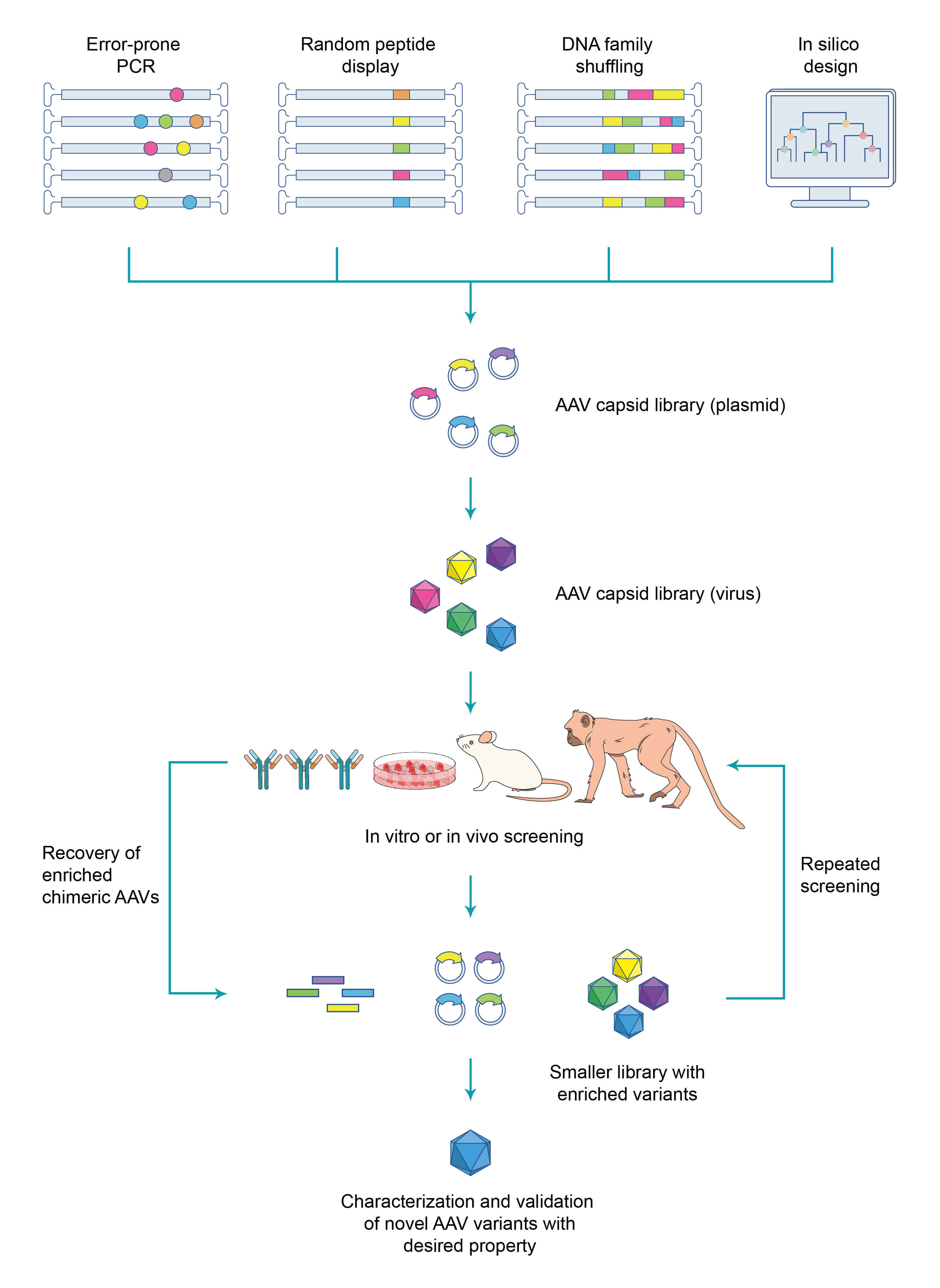
Figure 1. Directed evolution에 의하여 새로운 AAV capsid를 screening하는 일반적인 워크플로우.
Directed evolution에 의한 capsid library 제작
다음의 방법들은 일반적으로 다양한 AAV capsid 변이체들을 생성하는데 사용됩니다. 그런 다음, screening을 위한 capsid library는 capsid 변이체들을 AAV 벡터에 대량으로 클로닝하여 chimeric AAV 유전체 (각각 rep 유전자 및 변이 cap 유전자로 구성됨) 를 생성함으로써 제작됩니다.
Error-prone PCR
Error-prone PCR은 AAV capsid 유전자에 변이를 도입하기 위한 변형된 표준 PCR 방법을 포함하는 매우 가변적인 AAV capsid library를 개발하기 위한 가장 간단한 방법입니다. 좀 더 구체적으로, error-prone PCR은 AAV capsid 유전자에 임의의 점 변이 (random point mutation) 을 도입하기 위해 정확도가 낮은 polymerase, 더 긴 extension 시간, 더 높은 Mg2+ 농도, Mn2+ 추가 및 다양한 dNTP 농도를 포함하는 다양한 최적이 아닌 PCR 조건들의 조합을 사용합니다.
Random peptide display
Random peptide display는 바이러스의 세포와의 자연적인 상호작용을 변화시켜서 특정한 세포의 수용체로 타켓팅할 목적으로 AAV capsid의 특정 부위에 일반적으로 7~9개 아미노산으로 된 무작위 펩타이드 서열을 삽입합니다. 펩타이드 서열은 일반적으로 펩타이드가 capsid 단백질의 표면에 노출이 잘 될 수 있고 또한 바이러스-호스트 상호작용에 중요한 AAV capsid의 위치에 삽입됩니다. 예를 들어, AAV2 capsid의 587과 588 사이 (variable region VRIII 내) 는 대부분의 AAV2 기반의 peptide display library에서 선호되는 펩타이드 삽입 부위이며, 해당 영역에 펩타이드를 삽입하면 AAV2의 heparan sulfate proteoglycan (HSPG, primary AAV2 receptor) motif 가 제거되고 삽입된 펩타이드가 세포 표면의 분자들과 효율적으로 상호작용할 수 있습니다.
DNA family shuffling
DNA family shuffling은 서로 다른 AAV serotype들에서 유래된 부모 capsid 유전자의 분자 교배에 의해 chimeric AAV capsid를 생성하기 위한 매우 효율적인 방법입니다. 이를 달성하기 위해 다양한 AAV serotype의 부모 capsid 유전자들을 조각낸 후에 부분적인 서열 상동성에 의하여 이들을 재조합하는 primer-less PCR에 의해 새로운 full-length capsid 변이체로 재조합됩니다. 또 다른 방법으로는, rational design (AAV에 대한 사전 지식을 기반으로 capsid를 변형함) 을 directed evolution과 결합하는 synthetic shuffling에 의해 높은 복잡성을 갖는 library를 생성할 수도 있습니다. 이 방법에서는 자연적으로 존재하는 AAV serotype의 상세한 구조 및 서열 분석을 기반으로 하여 mutagenesis에 적합한 capsid 서열 내의 위치를 먼저 찾고 평가합니다. 변이를 포함하는 서열로 DNA를 합성하고 결합하여 새로운 full-length capsid 변이체가 형성됩니다.
In silico design
AAV capsid library의 in silico 디자인은 AAV 성능 향상에 기여할 수 있는 capsid 변이체 서열의 computational prediction을 위하여 다양한 방법을 활용합니다. 일반적으로 사용되는 방법 중 하나는 추정되는 원형 (ancestral) AAV library의 in silico 디자인을 포함하는 원형 재구성 (ancestral reconstruction) 이며, 이들로부터 개선된 tropism을 갖는 매우 강력한 원형 capsid 서열을 찾기 위한 실험적 검증이 뒤따릅니다. 이 방법의 이론적인 근거는 자연선택 과정에서 살아남은 진화적 중간체 AAV가 바이러스 구조와 기능을 유지하면서 고유한 특성을 가질 가능성이 높다는 점입니다. Machine learning은 가상의 capsid 변이체로부터 생존 가능한 바이러스의 생산 가능성을 예측하기 위해 computational algorithm을 적용하는 in silico 디자인 방법에서 일반적으로 사용되는 또 다른 방법입니다. Machine learning algorithm은 사용 가능한 입력 데이터에 크게 의존하여 단백질의 구조-기능 관계를 학습하고 이를 적용하여 바이러스 capsid 조립과 같은 복잡한 생리학적 과정의 결과를 예측하는데 이용됩니다.
Capsid library의 바이러스 패키징
Capsid library의 바이러스 패키징은 아래와 같이 one-step 또는 two-step 프로세스로 수행할 수 있습니다.
Capsid library의 one-step packaging
AAV capsid library를 패키징하기 위한 기존의 방법은 패키징 세포를 capsid library와 아데노바이러스 helper plasmid로 co-transfection하는 one-step 프로세스를 사용했습니다. 이 방법은 널리 사용되지만 cross-packaging (capsid 변이체의 유전체와 capsid가 일치하지 않는 AAV 입자를 생성함) 및 capsid mosaicism (다른 AAV 유전체들에서 만들어진 capsid 단백질로 구성된 모자이크 capsid가 있는 AAV 입자를 생성함)의 단점이 있습니다. 이러한 문제를 극복하기 위해 패키징 세포가 세포당 최대 한개의 library plasmid에 의해서만 transfection되도록 세포 수에 비하여 매우 낮은 수의 plasmid library를 transfection하는 것이 좋습니다.
Capsid library의 two-step packaging
Two-step 패키징 방법에서는 capsid library를 먼저 야생형 cap 유전자를 인코딩하지만 바이러스 ITR이 없는 helper plasmid와 함께 패키징 세포에 co-transfection합니다. 그 결과로 AAV transfer shuttle로 지칭되는부분적으로 야생형 VP 단백질로 구성된 모자이크 capsid가 있는 AAV 입자가 생성됩니다. 그런 다음 AAV transfer shuttle은 세포당 최대 하나의 바이러스 입자에 의해서만 감염이 되도록 낮은 MOI로 패키징 세포에 도입되고, 이어서 패키징 세포를 야생형 adenovirus로 superinfection시켜 최종적으로 높은 titer의 바이러스 capsid library를 얻게 됩니다.
In vitro 및 in vivo capsid screening
바이러스 capsid library는 일반적으로 원하는 특성을 가진 chimeric AAV를 선택하기 위해 screening 목적에 따라 in vitro 또는 in vivo에서 여러 차례의 선별 과정을 거칩니다.
In vitro selection
AAV capsid library 선별을 위해 확립된 세포주를 활용하는 것은 특히 수용체 타겟팅 능력이 변경된 AAV 변이체를 확인하는데 널리 사용되는 방법입니다. AAV library의 in vitro 선별은 빠르고 기술적으로 간단하지만 몇가지 문제가 있습니다. 첫째, in vitro에서 높은 transduction 효율을 갖도록 최적화된 벡터를 in vivo에서 사용될 때 동일한 효율을 재현하지 못할 수 있습니다. 둘째, in vitro에서 높은 수준의 타겟 세포 특이성을 나타내는 AAV 벡터가 in vivo에서 타겟으로 하지 않는 조직을 transduction 할 수도 있습니다. AAV library의 in vitro 선별을 위한 또 다른 전략으로 특히 면역 회피 특성을 가진 변이체를 식별하기 위해 library를 타겟 세포에 처리하기 전에 면역화된 동물의 강력한 혈청으로 library를 처리할 수도 있습니다. 그러나 AAV 변이체의 면역 반응은 다양한 요인으로 인해 in vivo에서는 달라질 수가 있습니다 (예를 들어, 동일한 AAV 벡터의 면역 인식은 다른 경로를 통해 투여될 때 다를 수 있음).
In vivo selection
In vivo 동물 모델은 AAV library screening을 위한 좀 더 신뢰할 수 있는 플랫폼을 제공하며, 특히 배양이 안되는 민감한 세포 유형을 transduction 할 수 있는 AAV 변이체 또는 복잡한 조직 구조 내에 존재하는 특정 세포 유형을 transduction 할 수 있는 AAV 변이체를 선별하기 위해 유용합니다. In vivo 선별은 또한 AAV 변이체와 관련된 잠재적인 off-target 효과를 찾는데 도움이 됩니다. 마우스와 NHP는 모두 AAV library의 in vivo 선별에 널리 사용되지만, NHP 모델은 인간과의 높은 유사성으로 인해 개선된 AAV 벡터를 screening하기 위한 임상적으로 가장 적절한 플랫폼입니다.



