IVT mRNA
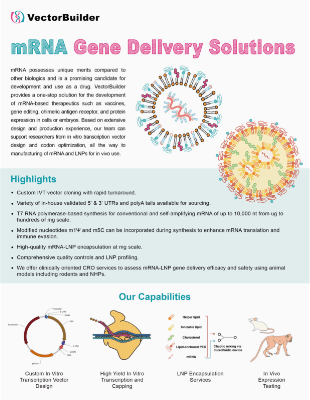
IVT (in vitro transcription) mRNA 는 삽입 돌연변이 유발 위험이 없고, 간소한 cell-free 제조 및 맞춤형 치료제 개발 등 유전자 전달에 대한 여러 장점을 가지고 있습니다. IVT mRNA는 백신, 단백질 대체, CAR-T 및 CRISPR 유전자 편집을 포함한 광범위한 치료제 응용 분야에 적용될 수 있습니다. VectorBuilder의 전문 RNA 팀은 커스텀 IVT mRNA 디자인, 생산 및 LNP encapsulation을 전문으로 하며 다양한 맞춤형 가능성을 제공합니다.
Talk to Our Experts
중점 사항

상업적 용도로 IP 제약이 없는 mRNA 생산을 위한 royalty-free IVT 백본

벡터 클로닝부터 LNP encapsulation까지 최단 5주 소요

Capping 방법, modified nucleotides, poly(A) tails 및 UTR을 포함한 포괄적인 커스터마이징

최고의 발현, 수율 및 품질을 위해 mRNA를 최적화하는 전문 디자인 및 생산팀
세부 사항
- Premade mRNA 제품
- Therapeutic RNA 개발: IVT 벡터 디자인 및 클로닝, IVT RNA 생산 및 정제.
- LNP Encapsulation: 표준 및 커스텀 formulations, antibody-conjugated LNP.
- CDMO 서비스: 공정 개발, GMP 제조, fill/finish.
기술적인 정보
다음 다이어그램은 mRNA의 기본 구성요소를 보여주며, 각 구성요소는 유전자 발현 조절에 중요한 역할을 합니다. in vitro에서 이러한 구성요소를 조립하는 방법은 다양하며 VectorBuilder는 프로젝트에 대한 최적의 발현, 수율 및 순도를 달성하기 위한 최상의 방법을 평가하고 서포트 합니다. 치료용 mRNA에 대한 더 자세한 내용은 Vector Academy의 mRNA 치료제의 기초를 참조하세요..
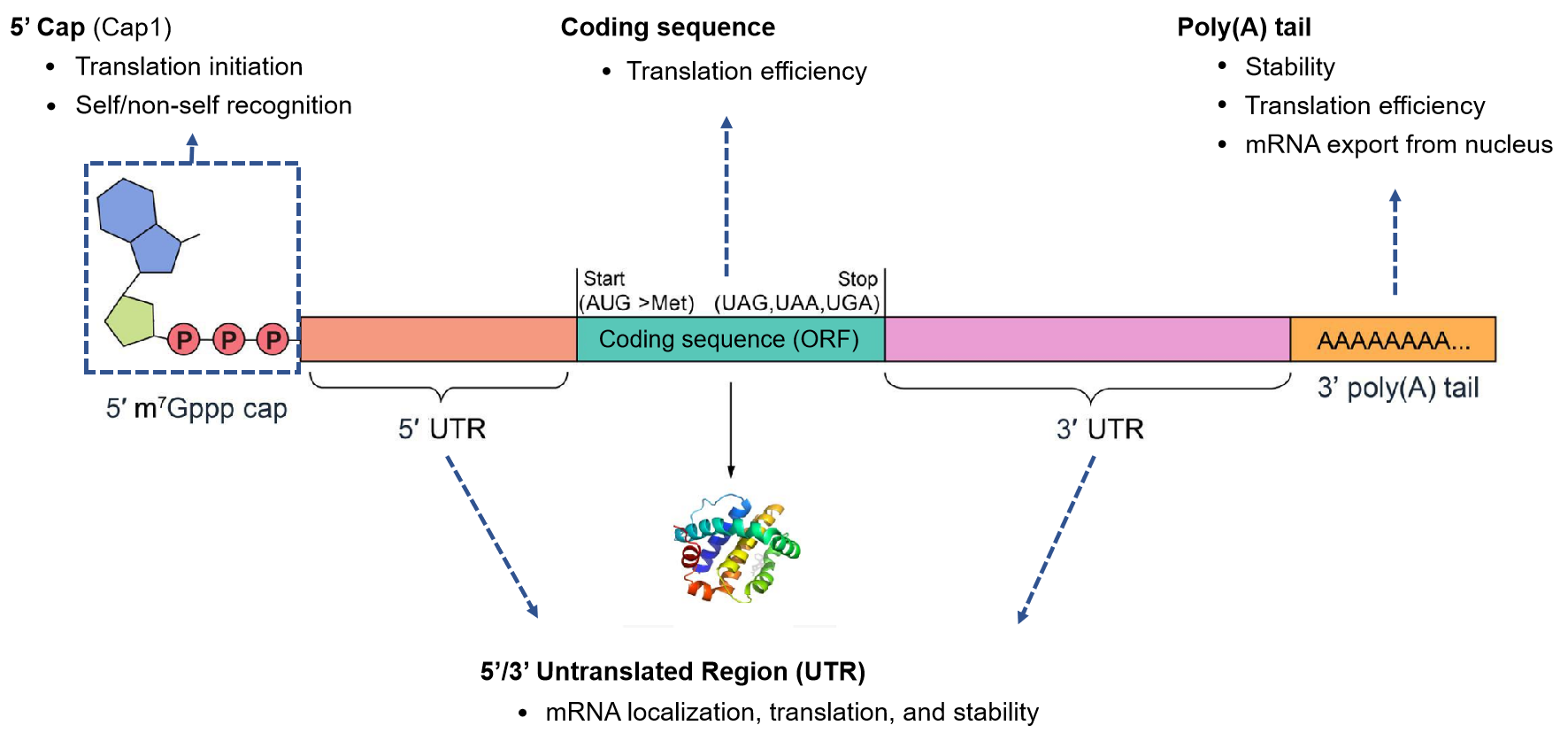
Figure 1. Structure and function of mRNA components.
- mRNA vaccine development
- CRISPR gene editing
- CAR-T
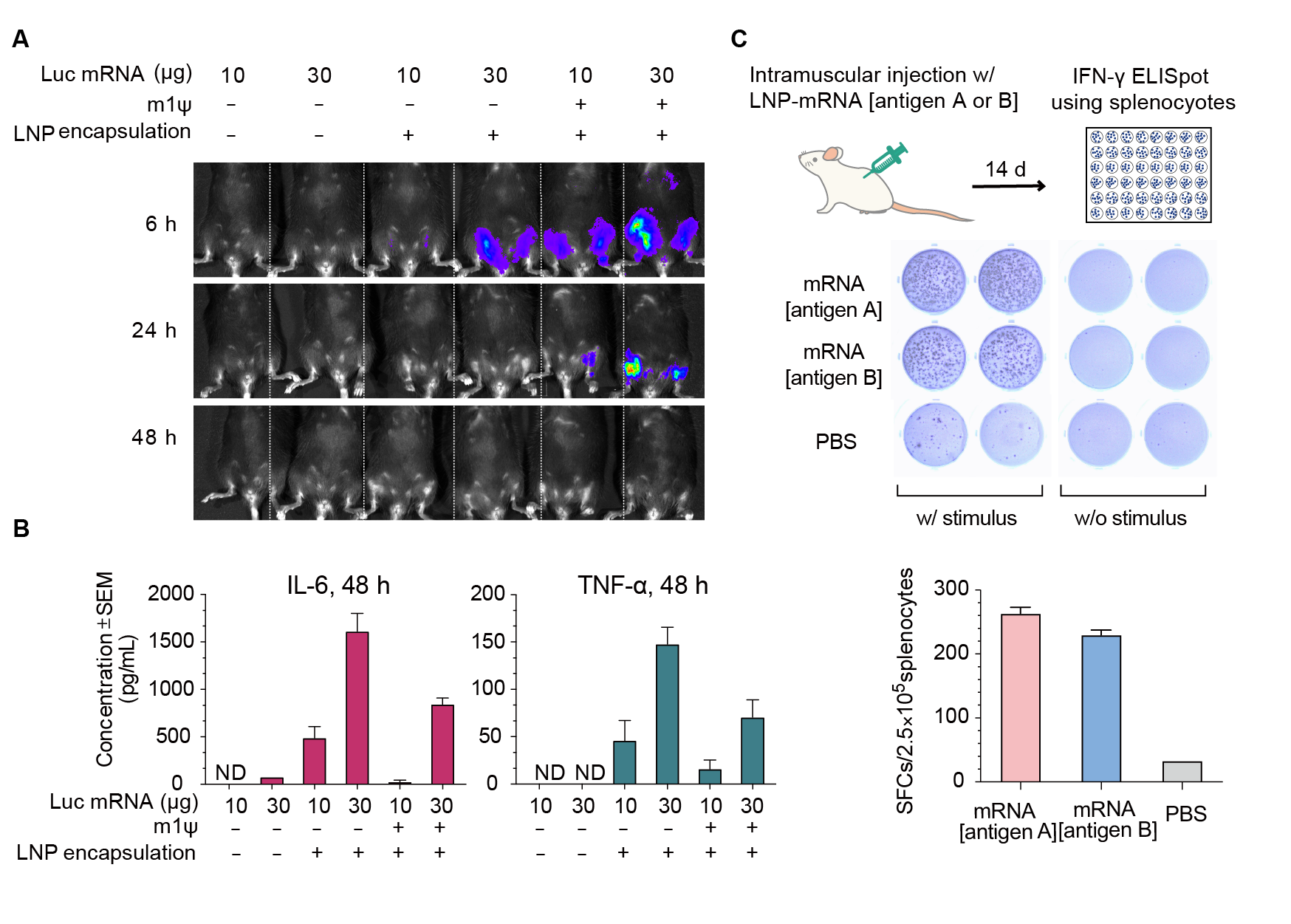
Figure 2. Expression of luciferase (Luc) mRNA and mRNA induced immune response in mice. (A) Luciferase activity visualized by live imaging at 6 h, 24 h, and 48 h post-injection. (B) Two pro-inflammatory cytokines, IL-6 and TNF-⍺, were quantified in the serum at 48 h post-injection. Error bars represent standard errors. Mice strain: C57BL/6J; mice age: 8 weeks; injection method: intramuscular injection. (C) IFN-γ ELISpot assay of splenocytes derived from Balb/C mice 14 days post intramuscular injection of 30 ug LNP-encapsulated mRNA coding for viral antigen A, viral antigen B, or control PBS.
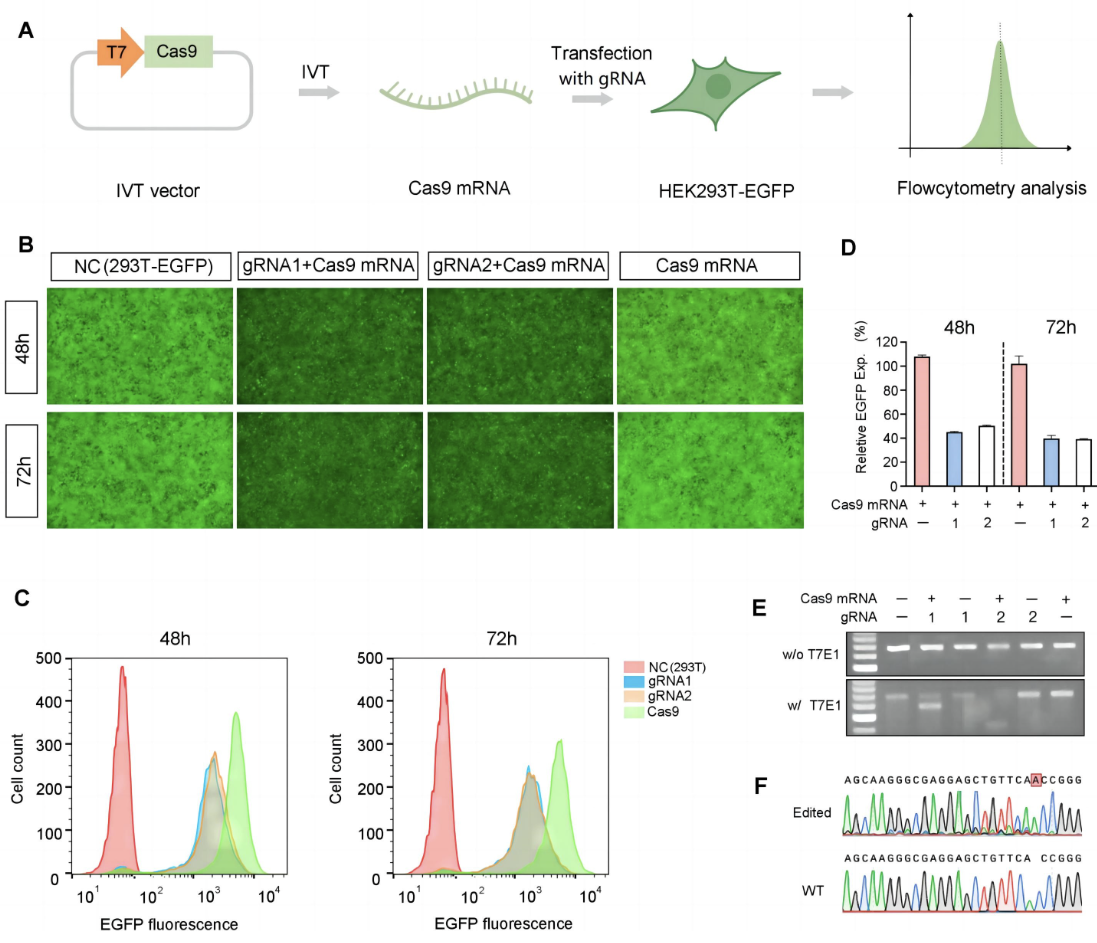
Figure 3. Validation of hSpCas9 mRNA in vitro. (A) IVT Cas9 mRNA was transfected into 293T-EGFP cells with two types of EGFP-targeting gRNA. EGFP expression in non-treated (NC) and transfected cells was observed by microscopy (B) and quantified using flow cytometry (C + D). (E + F) The editing to EGFP genes on the genome was further confirmed by T7E1 assay and Sanger sequencing.
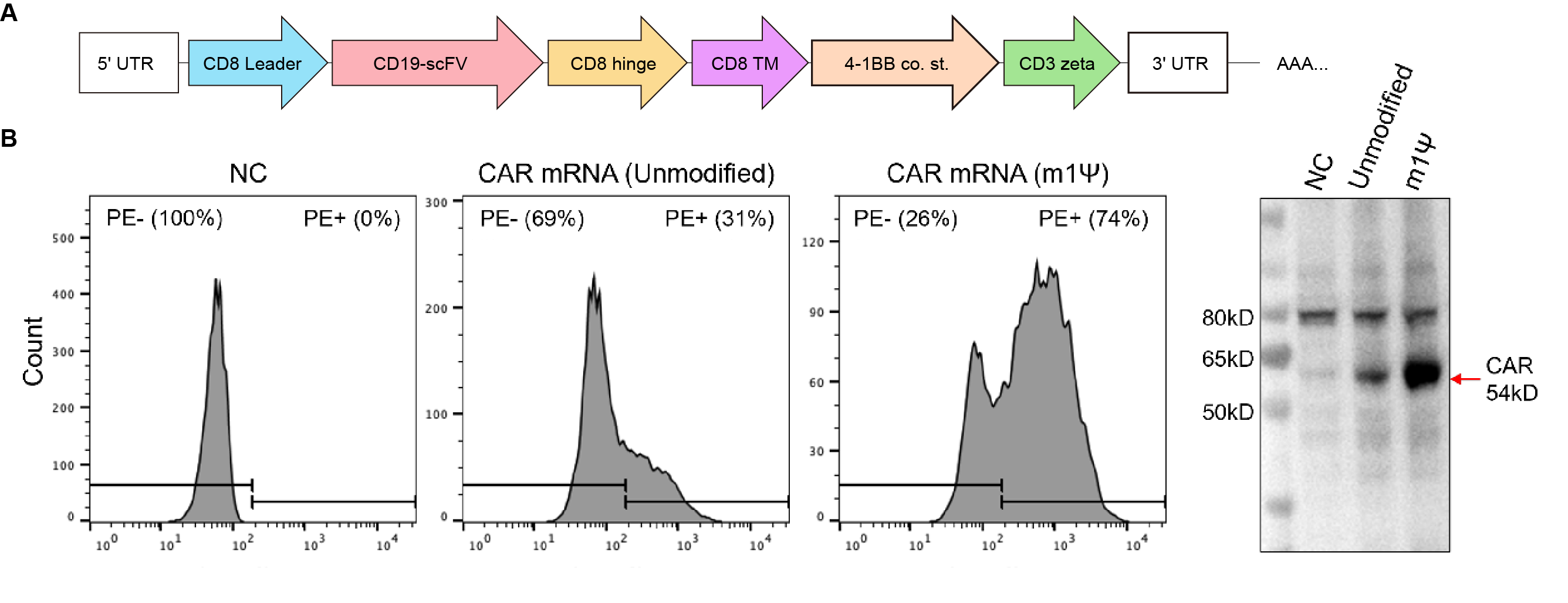
Figure 4. Validation of IVT Chimeric Antigen Receptor (CAR) mRNA expression in 293T cells. (A) CD19 CAR mRNA with robust 5’/3’ UTRs and poly(A) was generated with or without N1-Methylpseudouridine (m1Ψ) and used to transfect 293T cells. (B) 24h post transfection, cells were incubated with PE-labeled human CD19 to quantify CAR expression using FACS. (C) The expression was further validated using an anti-CD3zeta antibody and western blot.
FAQ
| mRNA | circRNA | saRNA | |
|---|---|---|---|
| Structure | Linear; usually contains 5’ cap, 5’ UTR, ORF for GOI, 3’ UTR, and poly(A) tail | Circular; usually contains IRES and ORF for GOI | Linear; usually contains 5’ UTR, ORFs for replicase genes and GOI, 3’ UTR, and poly(A) tail |
| Cap | Requires 5' Cap for stability and ribosome recruitment | No Cap; relies on IRES for ribosome recruitment | Requires 5’ Cap for stability and ribosome recruitment |
| RNA length (nt) | 100 ~ 10,000 | 1000 ~ 5000 | 7000 ~ 10,000 |
| Stability | Low | High | Low |
| Can modified nucleotides be added in production? | Yes | No | Yes |
| Expression level | Low | Medium | High |
| Expression duration | Short | Medium | Long |
| Immunogenicity | Low | Medium | High |
Cap 0은 5’ to 5’ triphosphate linkage를 통해 진핵생물 mRNA의 5' 말단에 추가되는 N7-methylguanosine (m7G)을 의미합니다. 이 변형은 co-transcription으로 발생하는 일련의 효소 반응을 통해 추가되고, nuclear export, transcript 안정성을 조절하는 역할을 하며, 진핵생물 translation initiation factor (eIF4E)에 의한 인식을 통해 mRNA의 번역을 촉진하는 일련의 효소 반응을 통해 추가됩니다. Cap 1은 m7G cap 외에 전사된 mRNA 서열의 첫번째 뉴클레오티드 (m7GpppNm)의 2'O에 methyl group이 추가되는 것을 의미합니다. 포유동물 세포에서 Cap 1 구조는 mRNA가 자기 자신으로 인식되고 innate immunity의 표적이 되지 않도록 하는 중요한 마커입니다. 합성된 mRNA에 Cap 1 구조를 추가하면 in vivo에서 mRNA 발현이 향상되고 면역원성이 감소하는 것으로 나타났습니다.
in vitro에서 전사된 RNA에 대한 capping은 cap analogs와 co-transcription하거나 enzymatic reaction을 통해 전사 후에 발생할 수 있습니다. VectorBuilder는 두가지 capping 방법을 모두 제공하며 그 효율성은 LC-MS를 사용하여 검증되었습니다. 고객이 선호하는 capping 방법에 따라 처음부터 IVT mRNA 벡터 클로닝에 호환되는 벡터 백본을 선택합니다.
세포에는 외부 RNA를 인식하면 면역 반응을 활성화하는 cytosolic 및 endosomal RNA receptors가 포함되어 있습니다. Modified nucleotide는 endogenous cellular RNA에서 흔히 발견됩니다. IVT mRNA에 특정 변형된 뉴클레오티드를 포함하면 면역원성이 감소하고, 2차 구조가 변경되며, 서열 의존적 방식으로 번역 효율성과 반감기가 증가합니다. VectorBuilder는 일반적으로 사용되는 N1-Methylpseudouridine(m1Ψ) 및 5-Methylcytosine(m5C)을 포함하여 광범위한 변형된 뉴클레오티드를 제공합니다. N1-Methylpsuedouridine과 5-Methylcytosine은 tRNA에서 처음으로 확인된 자연 발생 뉴클레오티드이지만, mRNA 코딩에 대한 사용은 최근에야 평가되었습니다. Uridine과 cytosine의 이러한 메틸화된 유도체는 전통적인 Watson-Crick 염기쌍을 변경하지 않고도 mRNA IVT 및 번역에서 일반 뉴클레오티드를 대체할 수 있습니다. mRNA 치료제에 사용 시 가장 큰 장점은 RNA immune receptor에 의한 인식을 변경하여 원치않는 면역 효과를 완화하고 전사체 안정성과 번역을 향상시키는 능력입니다.