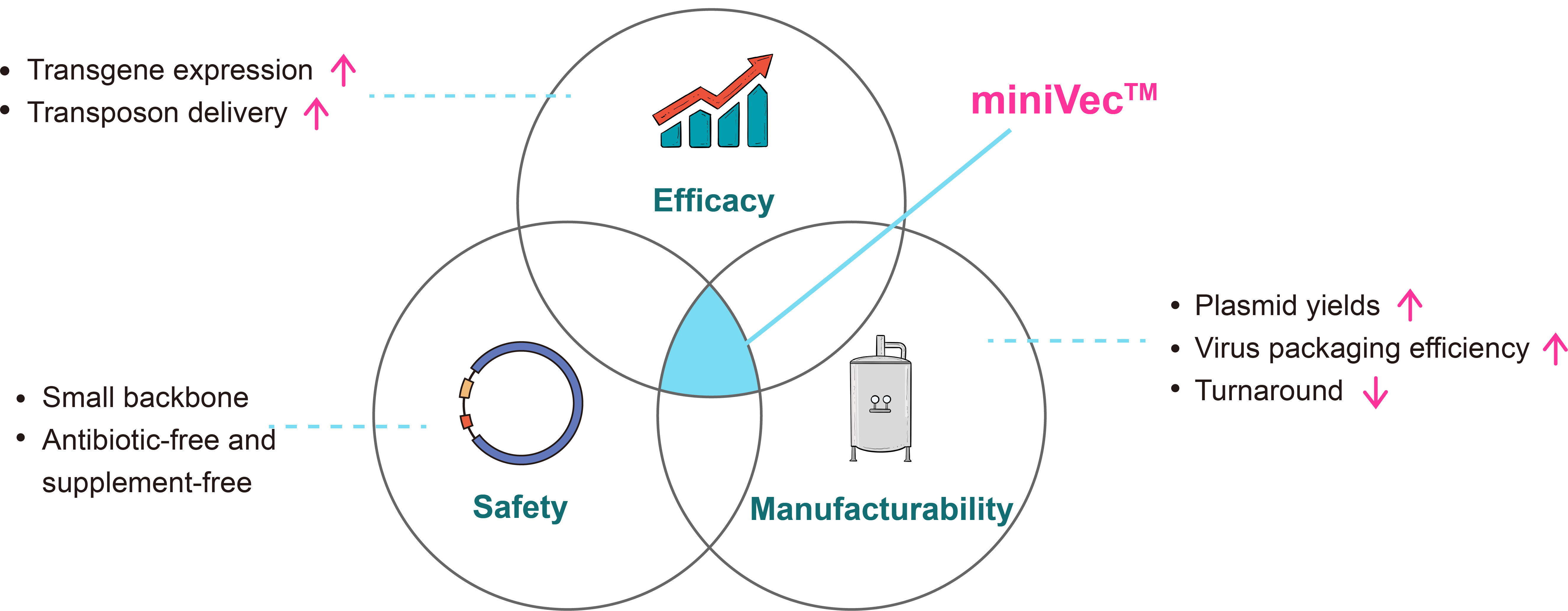
miniVec™ Plasmid

VectorBuilder의 독점적인 miniVec™ 플라스미드는 소형화된 백본으로 세포 및 유전자 치료에 놀라운 효능과 안전성 및 제조 가능성을 제공합니다. 기존 플라스미드와 비교해 miniVec™ 플라스미드는 더 높은 플라스미드 제조, 바이러스 패키징 수율, 향상된 유전자 발현 및 안전성을 제공합니다. miniVec™ 백본은 무항생제(antibiotic-free)와 무보충제(supplement-free) 선별입니다. miniVec™ 플라스미드는 렌티바이러스, AAV, in vitro transcription(IVT), 비바이러스 일반 플라스미드, piggyBac 및 Sleeping Beauty를 포함한 다양한 발현 시스템에 적용할 수 있습니다.
miniVec™ 기술
Figure 1 아래는 miniVec™ 시스템의 작동 방식을 보여줍니다. 시스템의 핵심 구성요소인 miniHost™는 성장 억제제 유전자를 함유한 변형된 대장균 균주입니다. miniVec™ 플라스미드로 형질전환한 후 miniHost™ 세포는 항생제 선별 과정 없이 일반 LB 배지에서 배양할 수 있습니다. miniVec™ 백본에서 전사된 VecSeqB는 성장 억제제 전사체의 상류에 위치한 VecSeqA와의 RNA-RNA 보완을 통해 성장 억제제 유전자 번역을 차단할 수 있습니다. 결과적으로, 성공적으로 형질전환된 숙주 세포만이 강력하게 증식하여 high copy miniVec™ 플라스미드를 생산합니다.
이러한 무항생제 선별은 향상된 안전성, 무항생제 의약품 제조 능력 등 다양한 장점을 제공합니다. VectorBuilder의 miniVec™ 기술은 무보충제 세포 생존 메커니즘으로 더욱 차별화되며, 벡터 생산 중 LB 배지에 추가 보충제가 필요하지 않습니다.
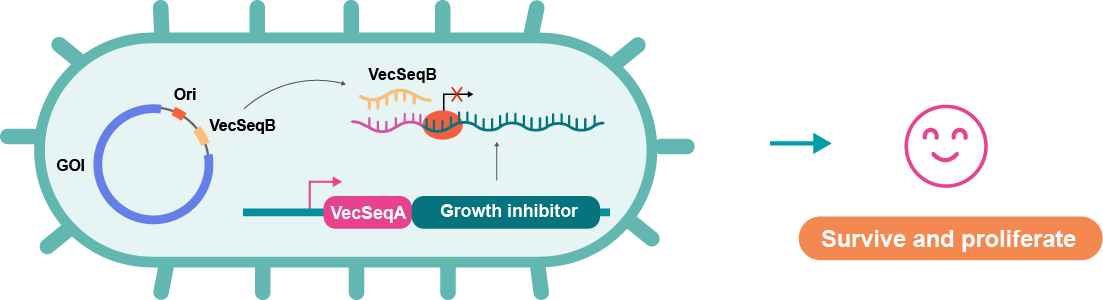
Figure 1. miniVec™ backbone의 선별 메커니즘
Plasmid 수율 증가
miniVec™ 플라스미드는 높은 카피수를 선호하는 fermentation, 보다 효율적인 replication 및 감소된 metabolic 부담을 포함한 여러 주요 메커니즘으로 인해 기존 플라스미드에 비해 더 높은 제조 수율을 달성할 수 있습니다.
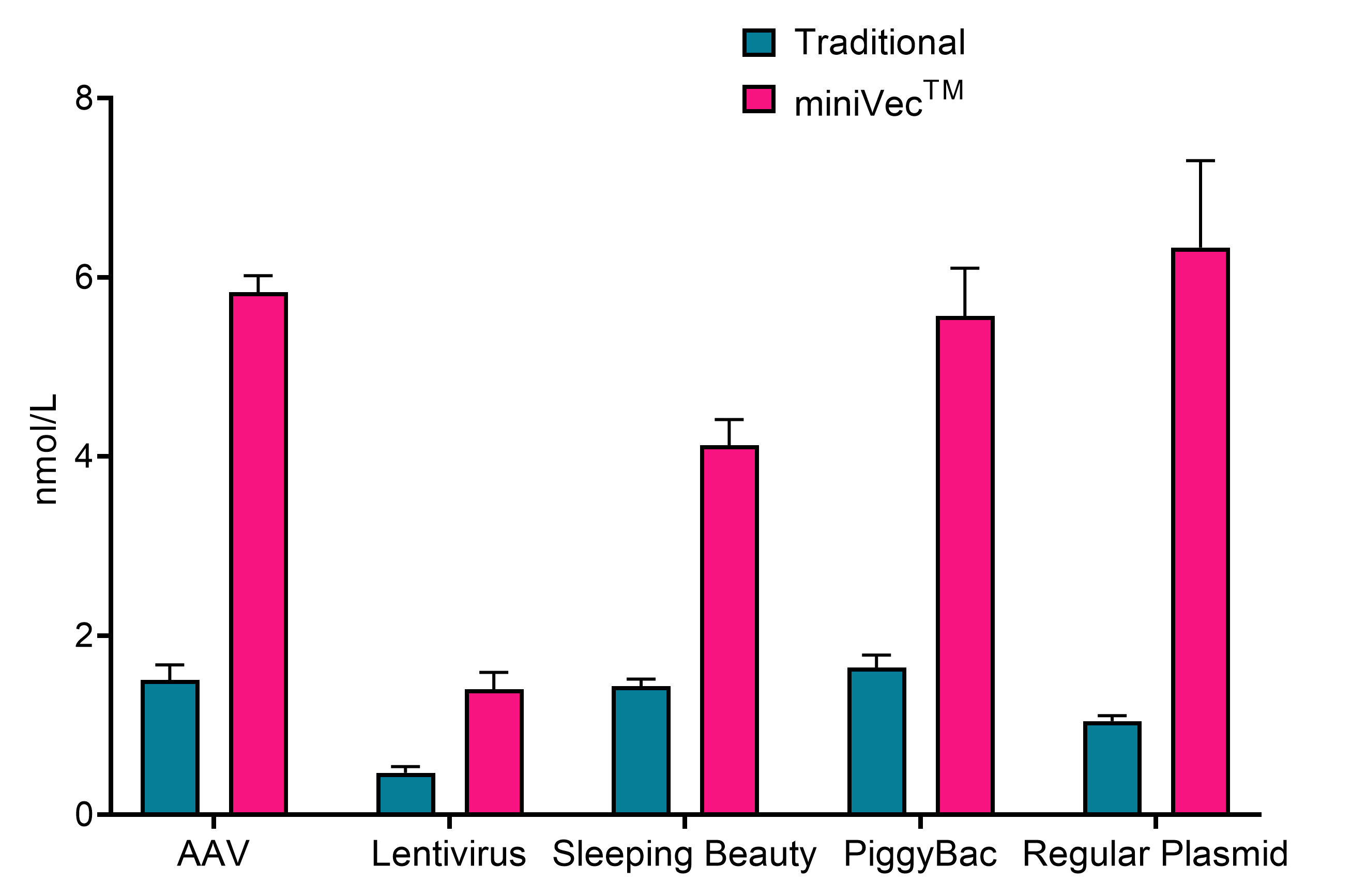
Figure 2. miniVec™은 기존 플라스미드에 비해 증가된 플라스미드 수율을 보여줍니다. 다양한 발현 시스템의 기존 플라스미드와 miniVecTM 플라스미드로 형질전환된 동일한 조건으로 E. coli를 실험실 규모로 배양해 플라스미드 수율을 측정하였습니다.
향상된 유전자 발현
miniVec™ 플라스미드는 기존 플라스미드와 비교하여 in vitro에서 향상된 도입유전자 발현에 대해 검증되었습니다. 포유류 세포의 면역 반응 위험을 완화하는 최소 박테리아 백본은 추가적으로 숙주 세포 스트레스를 최소화하고 세포 흡수 및 이동을 증가시킬 수 있습니다.
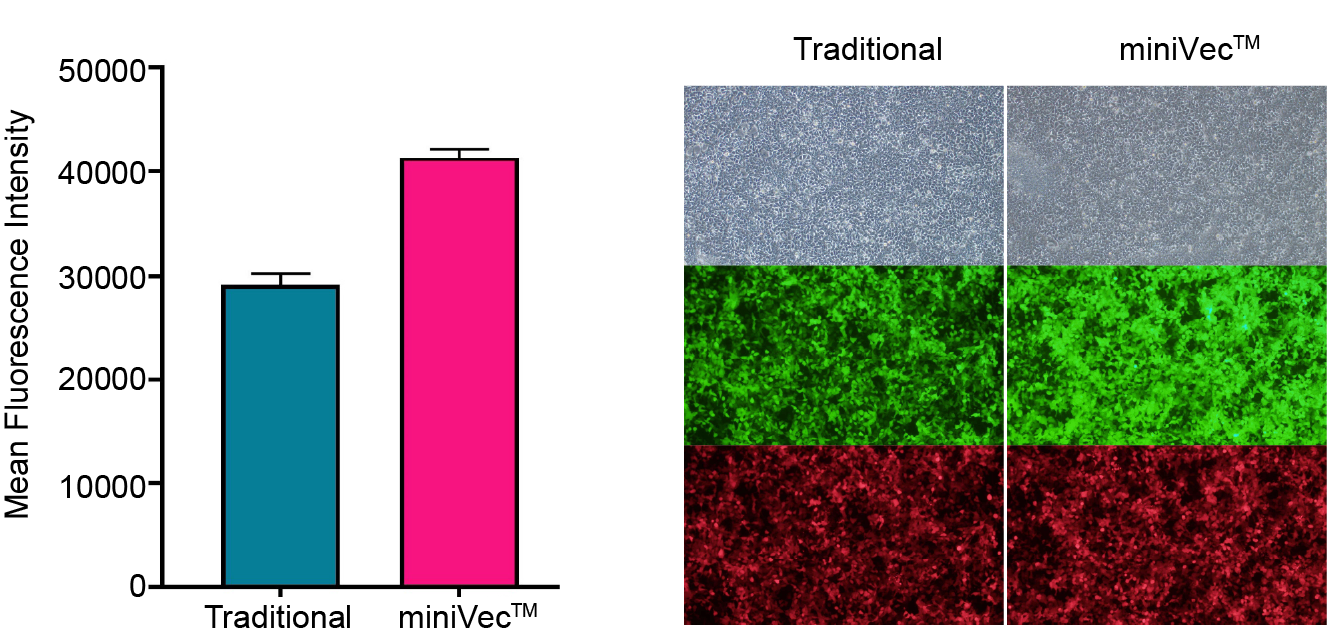
Figure 3. miniVec™은 flow cytometry와 형광 현미경으로 측정했을 때 동일 몰(molar)로 형질감염시킨 48시간 후 HEK-293T 세포에서 기존 플라스미드와 비교하여 EGFP 발현의 증가를 나타냅니다. mCherry 발현 플라스미드를 형질감염 대조군으로 co-transfection 시켰습니다.Average mean fluorescence intensity (MFI) of all viable cells was calculated.
miniVec™ 플라스미드는 기존 플라스미드에 비해 생체 내 도입유전자 발현이 향상된 것으로 추가로 검증되었습니다. 이러한 특징으로 인해 miniVec™은 유전자 치료 및 DNA 백신에 이상적인 후보입니다.
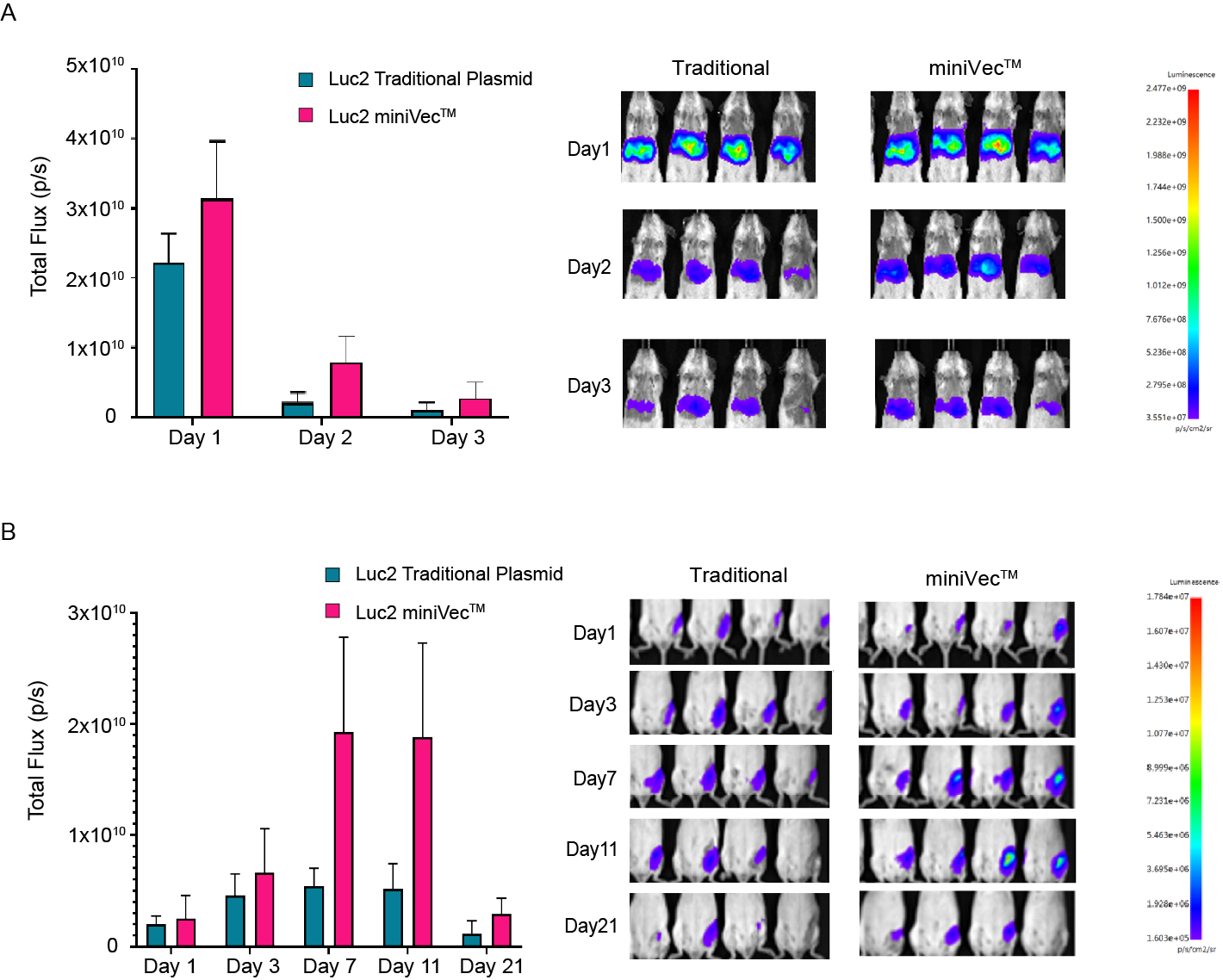
Figure 4. miniVec™은 생쥐의 기존 플라스미드에 비해 luciferase 발현이 증가하고 기간이 연장된 것으로 나타났습니다. 플라스미드(CAG>Luc2)를 (A) 정맥 내로 또는 (B) 근육 내로 동일한 몰 농도로 투여했습니다.
효율적인Transposon 전달
miniVec™은 간소화된 디자인, 숙주 세포의 대사 부담 감소, 향상된 안전성 프로파일로 인해 piggyBac 및 Sleeping Beauty transposon 시스템에 이상적입니다. 이러한 특징을 통해 miniVec™은 세포 내에서 유사하거나 향상된 transposition 효율을 달성할 수 있습니다.
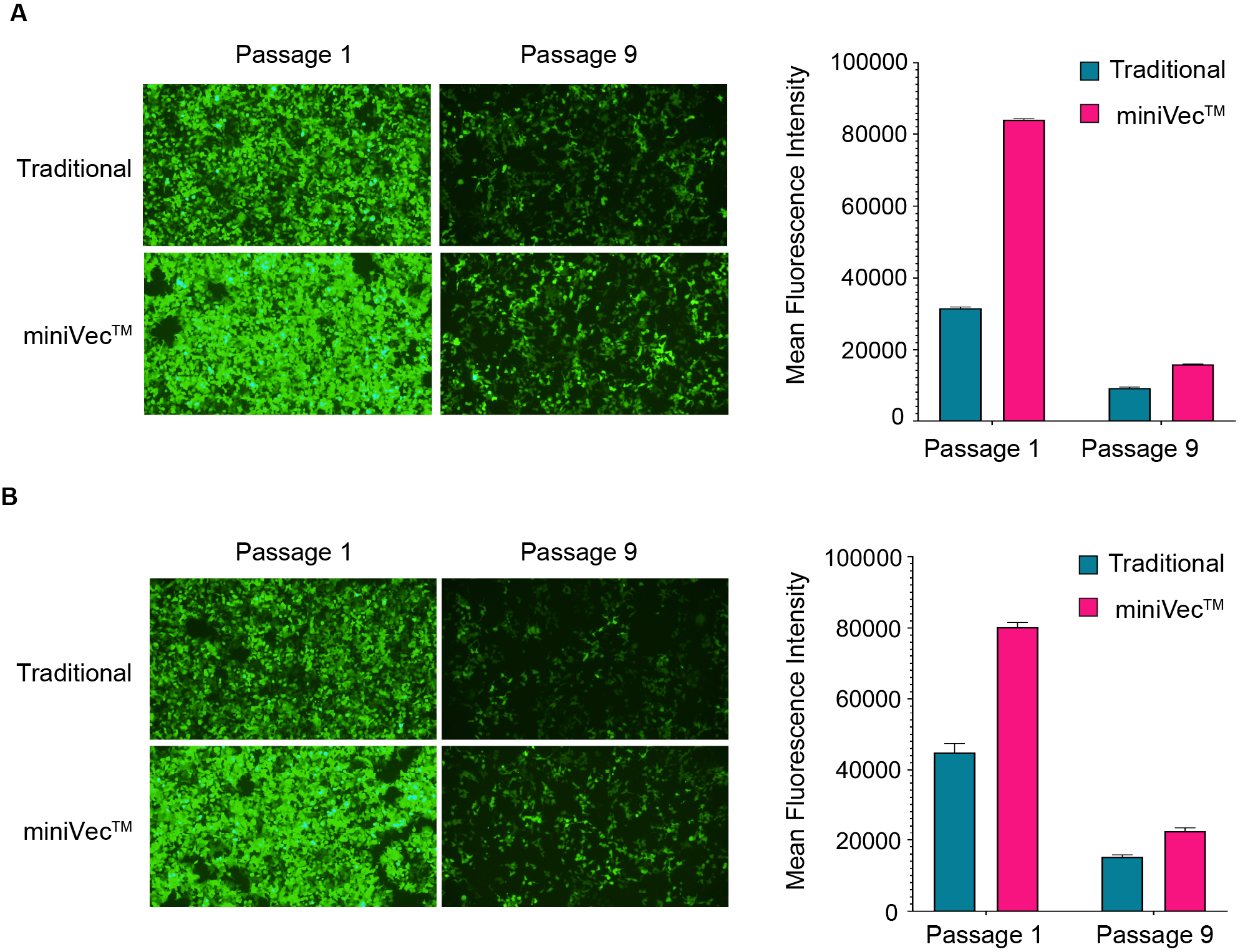
Figure 5. Flow cytometry로 측정한 HEK-293T 세포의 (A) piggyBac 및 (B) Sleeping Beauty 시스템에 대한 기존 플라스미드와 miniVec™ 플라스미드 간의 transposition 효율 비교 분석. 모든 생존 세포의 평균 mean fluorescence intensity (MFI)를 계산했습니다.
바이러스 패키징을 위한 보다 안전한 원재료
miniVec™ 플라스미드는 재조합 바이러스의 GMP 생산에서 전통적인 항생제 의존성 플라스미드에 대한 보다 안전한 대안을 제공하여 최종 제품에서 잠재적인 항생제 잔류 위험을 줄이고 수평 유전자 전달 위험을 완화합니다. 이는 GMP 공정의 안전성 프로파일을 강화하고 규제 표준 준수를 지원하며 최종 제품의 순도를 보장합니다. 또한, miniVec™ 패키징 플라스미드는 기존 플라스미드 보다 바이러스 패키징에 대해 더 높은 역가를 달성하는 것으로 나타났습니다.

Figure 6. 기존 플라스미드와 miniVec™ 플라스미드를 사용한 렌티바이러스 패키징 비교. (A) miniVec™ 플라스미드를 사용하면 더 높은 렌티바이러스 역가가 달성됩니다. 기능적 바이러스 역가는 형질도입 후 qPCR에 의해 측정되었습니다. (B) 기존 플라스미드와 miniVec™ 플라스미드를 사용하여 병렬로 생산된 렌티바이러스의 동일 부피 형질도입을 통한 EGFP 발현 비교. 모든 생존 세포의 평균 mean fluorescence intensity (MFI)를 계산했습니다.



