바이러스 패키징 Plasmid

VectorBuilder는 유전자치료 및 세포치료용 전임상 및 임상 바이러스 벡터 제조를 위한 GMP-like 및 GMP-grade의 렌티바이러스 및 AAV 패키징 plasmid를 제공합니다. 최첨단 시설에서 생산되는 각각의 plasmid는 높은 titer의 바이러스를 생산할 수 있도록 최적화되었으며, 철저한 품질관리를 거쳤습니다.
제공되는 plasmid
- GMP-like 및 GMP-grade lentivirus packaging plasmids VB-VSV-G, VB-Rev, 및 VB-Gag/Pol
- GMP-like 및 GMP-grade VB-AAV-Helper plasmid
- GMP-like 및 GMP-grade VB-AAV2-Rep/Cap 및 VB-AAV9-Rep/Cap plasmids
중점 사항
- 높은 바이러스 수율을 위해 최적화 및 검증 완료
- 바로 사용할 수 있는 plasmid
- Animal-free 및 antibiotic-free 조건에서 생산된 plasmid
- Royalty free
- FDA IND 신청을 간소화하는 DMF 가능
- Kan resistance
제공되는 패키징 plasmid 등급
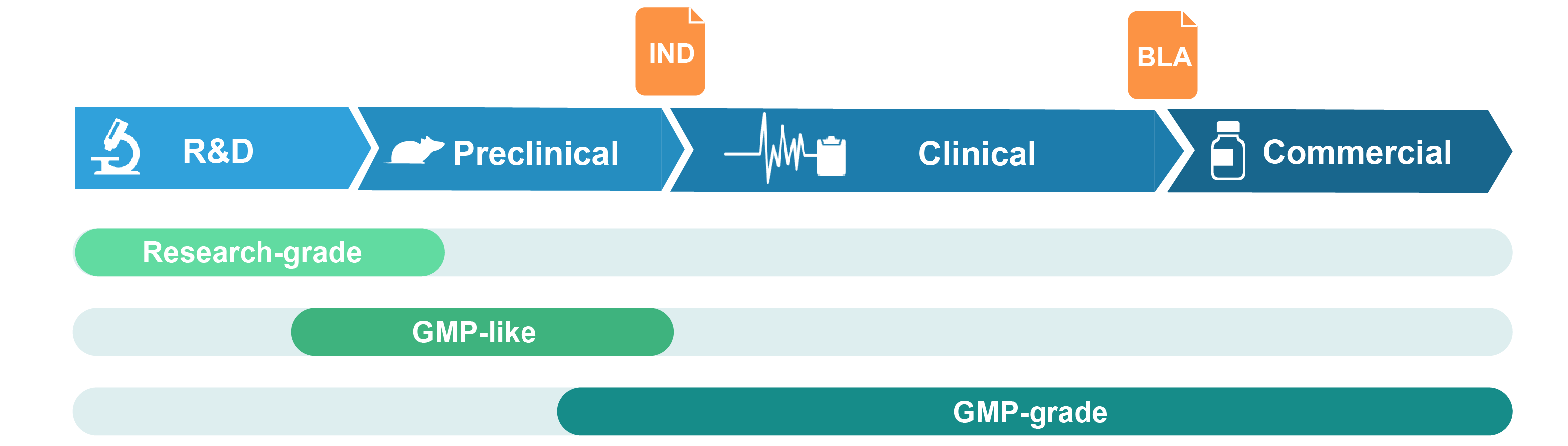
-
GMP-like plasmid
GMP-like plasmid DNA는 약물 안전성 및 약물 대사에 대한 동물 실험과 같은 전임상 연구를 위한 것입니다. 비교 가능한 생산 공정 및 유사한 품질 특성을 포함하여 GMP 가이드라인의 주요 특징을 채택하는 방식으로 생산됩니다. 생산은 문서관리 및 추적 가능한 구분된 생산시설에서 수행됩니다. 따라서 GMP-like 등급은 최종 GMP 제품의 소규모 모방품으로 볼 수 있고, 비용은 훨씬 저렴하고 납기는 더 빠릅니다. COA(Certificate of Analysis) 및 TSE/BSE statements가 제품 출하 시에 제공됩니다.
-
GMP-grade plasmid
GMP-grade plasmid DNA는 GMP 가이드라인을 엄격히 준수하고 인증된 GMP 시설에서 생산됩니다. 포괄적인 품질 보증 시스템이 생산공정 전반에 걸쳐 구현됩니다. Plasmid DNA가 원하는 품질 및 안전 기준을 충족하거나 초과하는지 확인하기 위해 광범위한 공정 중 및 출하 QC 분석이 수행됩니다. 제품 출하 시 생산 프로세스와 COA를 완전히 문서화한 배치 출하 보고서가 제공됩니다.
Learn more about our GMP plasmid manufacturing
| Product | Quantity | GMP-like | GMP-grade |
|---|---|---|---|
|
5 mg | Please inquire | Please inquire |
| 10 mg |
품질관리 및 출하 기준
GMP-like 및 GMP-grade plasmid 출하를 위한 주요 QC 분석 및 사양이 아래에 요약되어 있습니다.
| QC | Method | GMP-like | GMP-grade |
|---|---|---|---|
| Plasmid concentration | UV spectrophotometry | ≥500 ug/ml | ≥500 ug/ml |
| Restriction digestion | Agarose gel electrophoresis | Identical to expected restriction pattern | Identical to expected restriction pattern |
| Sanger sequencing | Sanger sequencing of the entire plasmid | Identical to reference sequence | Identical to reference sequence |
| A260/A280 | UV spectrophotometry | 1.80-2.00 | 1.80-2.00 |
| ccc plasmid DNA ratio | EtBr stained agarose gel electrophoresis | ≥80% | ≥80% |
| Residual protein | BCA or equivalent | ≤2.00% | ≤2.00% |
| Residual RNA | Fluorescence analysis or equivalent | ≤5.00% | ≤5.00% |
| Residual host cell DNA | Quantitative PCR or equivalent | Report result | ≤5.00% |
| Endotoxin | Kinetic chromogenic assay | ≤50 EU/ml | ≤10 EU/ml |
| Sterility | Direct inoculation | No growth | No growth |
문서자료
브로셔 & 리플렛


