AAV 생체내 분포 분석(AAV Biodistribution Profiling)
재조합 아데노부속바이러스 (adeno-associated virus, AAV) 는 최근 광범위한 유전자 치료 및 백신 응용 분야에서 널리 사용되는 유전자 전달 벡터입니다. AAV 벡터의 치료제로서의 잠재성과 안전성을 평가할 때 반드시 고려해야할 사항은 다양한 기관 및 조직에서의 분포 및 지속성입니다.
일반적으로 사용되는 AAV serotype에 대한 일부 생체내 분포에 대한 연구 결과가 보고되어 왔지만, 모두 적정한 수준과는 거리가 있습니다. 기존의 연구 결과들은 일반적으로 기관 내의 여러 다른 세포 유형에 대한 검사 없이 기관 수준의 해상도로 제한되었습니다. 또한 일반적으로 다른 투여 경로를 조사하지 않고 정맥 주사에만 중점을 뒀습니다. 중요한 점은 대부분의 연구가 설치류에 대하여 수행되었기 때문에, 그 결과를 진화 및 생리학적인 차이가 큰 인간을 대상으로 추정할 수 있는지에 대한 심각한 의문이 제기하고 있습니다. 또한 새로 개발된 많은 천연 및 합성 AAV serotype들은 생체내 분포에 대한 데이터가 전체적으로 부족합니다. 이러한 문제와 더불어 동일한 serotype으로 패키징된 다른 벡터 서열들은 각각의 벡터가 포함하고 있는 다른 transgene들이 선천적 면역을 포함한 다른 세포 반응을 유발할 수 있기 때문에, 여전히 다른 생체내 분포를 나타낼 가능성이 있습니다.
VectorBuilder에서 제공하는 AAV 생체내 분포 profiling 서비스는 이러한 모든 문제를 극복하고 가장 적합한 생물종에서 고해상도의 데이터를 얻을 수 있도록 도와 드립니다. 특히 주목할만한 점은 비인간 영장류 (NHP, non-human primates) 에서 생체내 분포 profiling을 수행할 수 있는 능력입니다. 아래에 설명된 바와 같이 VectorBuilder는 가장 포괄적인 AAV 생체내 분포 연구를 제공할 수 있습니다.
서비스 중점 사항
- 전체적인 서비스 플랫폼: VectorBuilder는 모든 AAV 전임상, 임상 CRO 및 CDMO의 수요에 대한 원스톱 솔루션을 제공할 수 있는 세계 유일의 회사입니다. 당사의 AAV 서비스에는 vector 디자인 및 최적화, vector 클로닝, 바이러스 패키징, capsid evolution 및 targeted engineering, AAV 생체내 분포 분석 및 GMP 제조가 포함됩니다.
- 비인간 영장류 (NHP) 를 포함하는 여러 생물종: in vivo 생체내 분포 연구를 위해서 mouse, rat, 그리고 중요하게는 두가지 비인간 영장류 종인 crab-eating macaque (Macaca fascicularis, cynomolgus monkey라고도 함)과 rhesus macaque (Macaca Mulatta)과 같은 다양한 종을 제공합니다. 연구는 고도로 훈련된 전문가에 의해 AAALAC 인증 시설에서 수행됩니다.
- 다양한 분석 방법: 기관, 조직 및 세포 수준의 AAV 생체내 분포를 조사하기 위해서 형광 reporter의 영상화, flow sorting에 의한 형광 양성 세포의 분리, luciferase reporter 활성의 정량화, qPCR에 의한 유전체 내의 copy 수 분석, RT-qPCR에 의한 GOI 발현 분석 등을 포함하는 다양한 분석을 수행할 수 있습니다.
- 바코드 및 NGS를 사용하는 다중 분석: 많은 전임상 AAV 파이프라인은 추가 연구에 가장 적합한 것을 선택하기 전에 여러 유형의 벡터에 대한 생체내 분포를 비교해야 합니다. 다른 serotype들로 패키징된 동일한 벡터 디자인 또는 동일한 serotype으로 패키징된 다른 벡터 디자인에서 경우에 이러한 비교 연구가 필요합니다. VectorBuilder는 동일한 동물 내에서 서로 다른 벡터의 생체내 분포를 평가하기 위한 자체의 플랫폼을 개발했습니다. 구체적으로, 각각 다른 바코드를 각각의 벡터에 포함하여, 주어진 조직에서 AAV 벡터의 유전체 DNA 또는 mRNA의 분포를 바코드의 next-generation sequencing (NGS) 에 의해 확인할 수 있습니다. 이 방식은 비용과 시간을 크게 줄일 수 있으며, 더 중요하게는 조직 내의 다양한 벡터들이 서로의 internal references로 사용될 수 있도록 함으로써 데이터의 민감도와 신뢰도를 높일 수 있습니다.
- 자체적으로 보유하고 있는 많은 AAV serotype들: AAV 벡터를 패키징하기 위한 다양한 serotype을 제공합니다 (1, 2, 3, 4, 5, 6, 6.2, 7, 8, 9, rh10, DJ, DJ/8, PHP.eB, PHP.S, AAV2-retro, AAV2-QuadYF, AAV2.7m8, etc.). 또한 고객의 니즈에 따라 새로운 serotype을 신속하게 개발할 수 있습니다.
- 다양한 투여 경로: Tail vein injection, facial vein injection (for neonatal mice and rats), intracerebroventricular injection, intrathecal injection, subretinal injection, intravitreal injection, intratympanic injection, intramuscular injection 등의 다양한 AAV 투여 방법을 사용할 수 있습니다.
- 전체적인 기술 지원: 경험이 풍부한 당사의 과학자들은 벡터 디자인 및 최적화에서 GMP 제조를 포함한 바이러스 패키징, 세포 배양 분석에서 동물 수술에 이르기까지 AAV 프로젝트의 모든 단계를 포함하는 포괄적인 기술 지원을 제공할 수 있습니다.
실험 데이터
다음은 당사의 고품질 AAV 생산 및 AAV 생체내 분포 profiling에 대한 전문성을 보여주는 몇가지 예입니다.
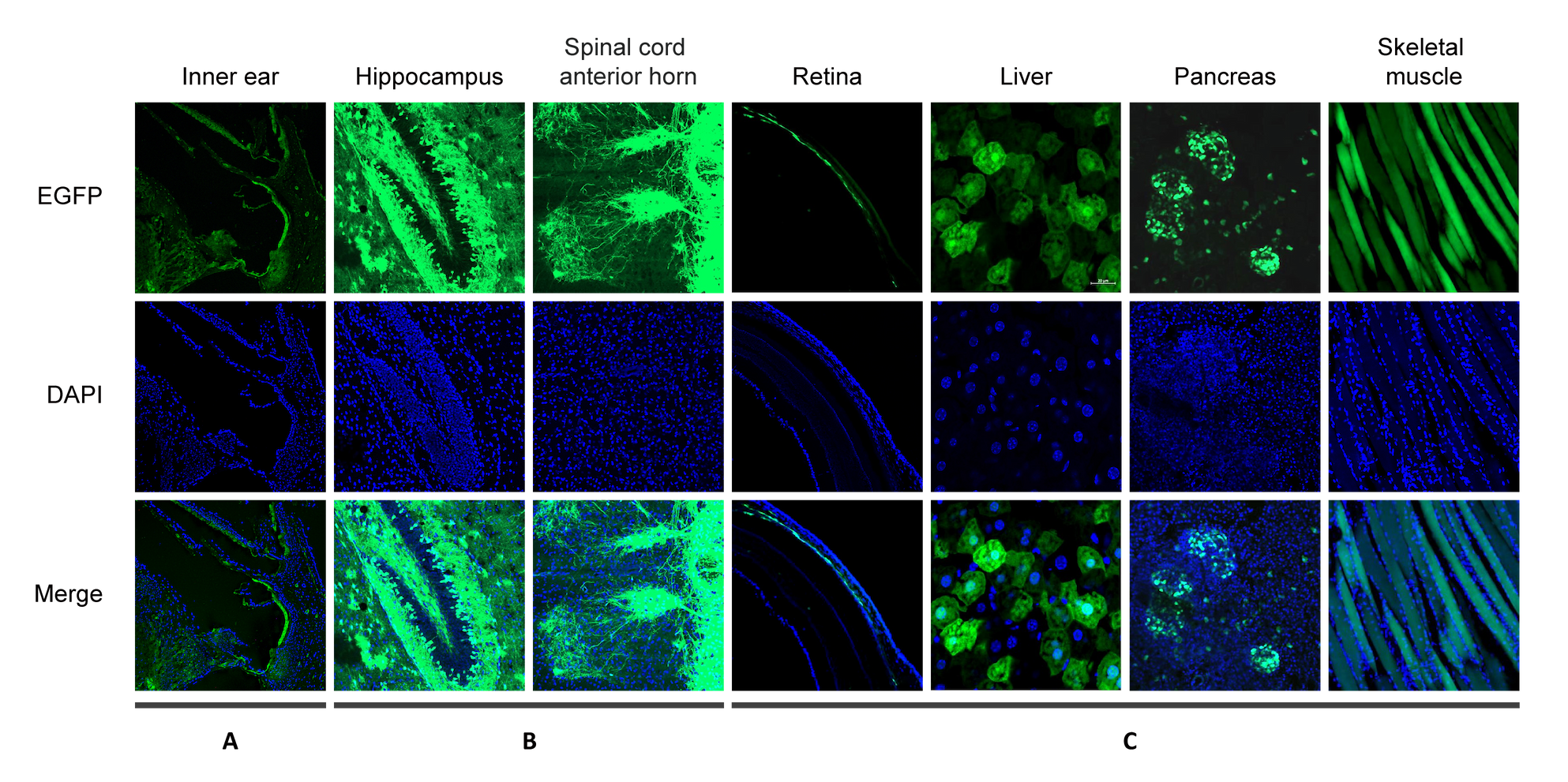
Figure 1. CAG promoter에 의해 EGFP가 발현되는 AAV9 벡터를 다양한 경로로 마우스에 투여 했습니다. EGFP와 DAPI에 의한 형광을 다음의 기관에서 분석했습니다: (A) inner ear, intratympanic injection에 의하여 왼쪽 귀에 벡터를 투여 후 13일 후의 이미지입니다; (B) hippocampus 및 spinal cord anterior horn, facial vein injection에 의하여 벡터를 투여 후 10일 후의 이미지입니다; (C) retina, liver, pancreas, and skeletal muscle, tail vain injection에 의하여 벡터를 투여 후 12일 후의 이미지입니다.
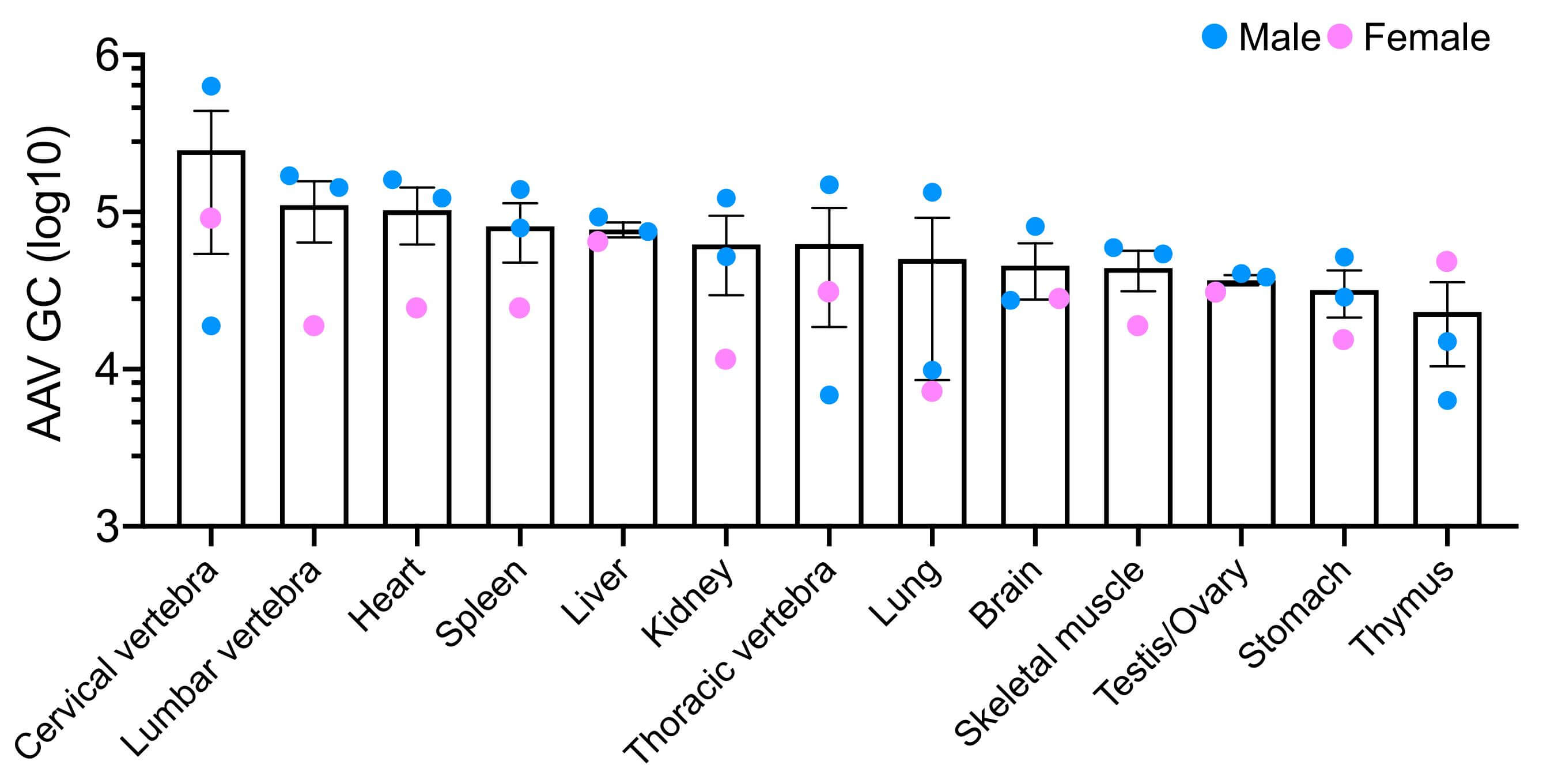
Figure 2. 재조합 AAV9 입자(~1.5X1010 GC/mouse)를 출생 후 48시간 이내의 3마리 마우스(수컷 2마리, 암컷 1마리)에 정맥내 투여하였습니다. 투여 후 6주 후에 qPCR을 사용하여 여러 기관에서 AAV9 생체내 분포 분석을 정량화하였습니다.
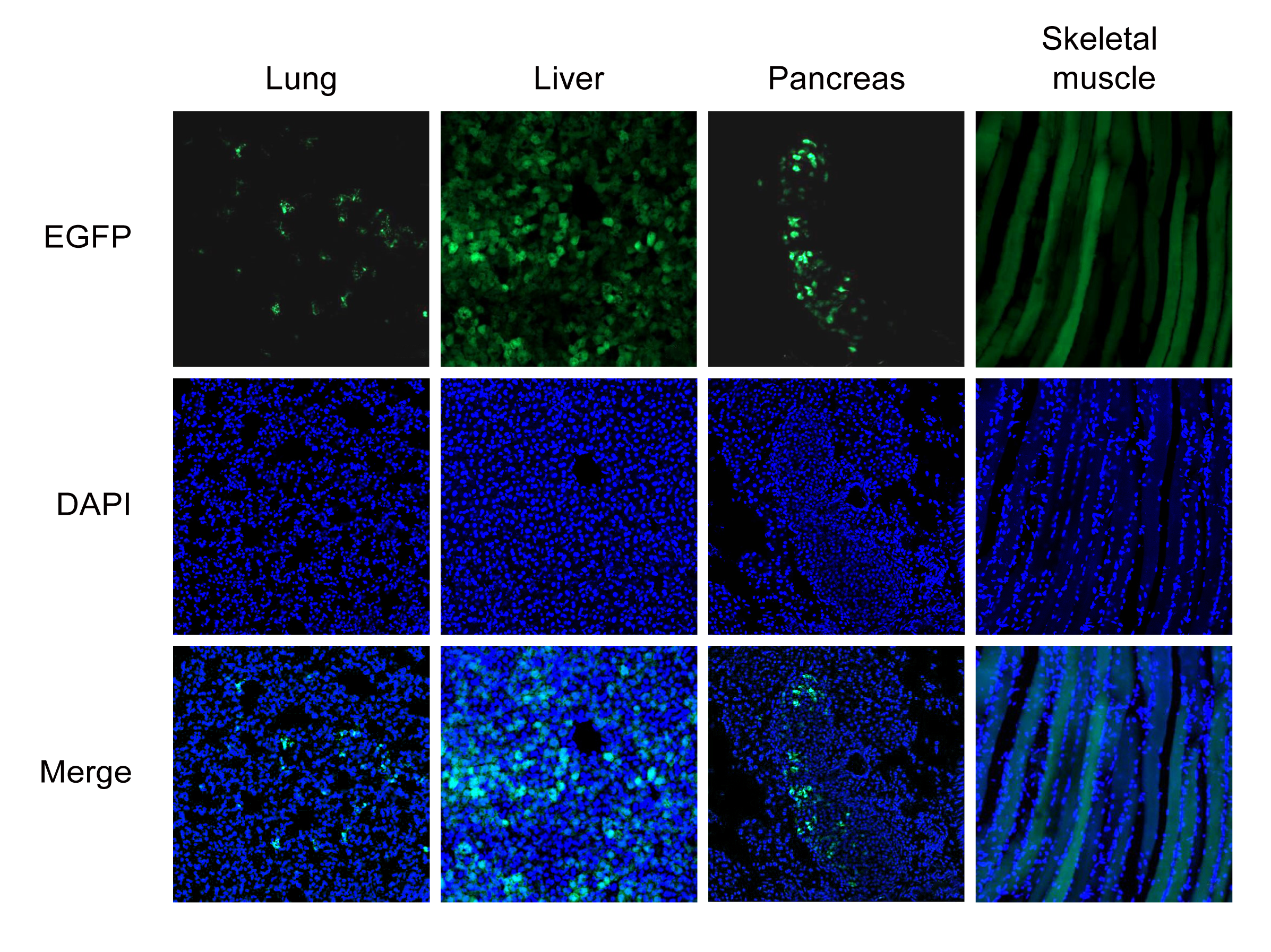
Figure 3. AAV1 carrying CMV promoter에 의해 EGFP가 발현되는 AAV1 벡터를 tail vein injection에 의하여 마우스에 투여했습니다. EGFP와 DAPI에 의한 형광을 lung, liver, pancreas, 및 skeletal muscle에서 분석하였습니다. 투여 후 12일 후의 이미지입니다.
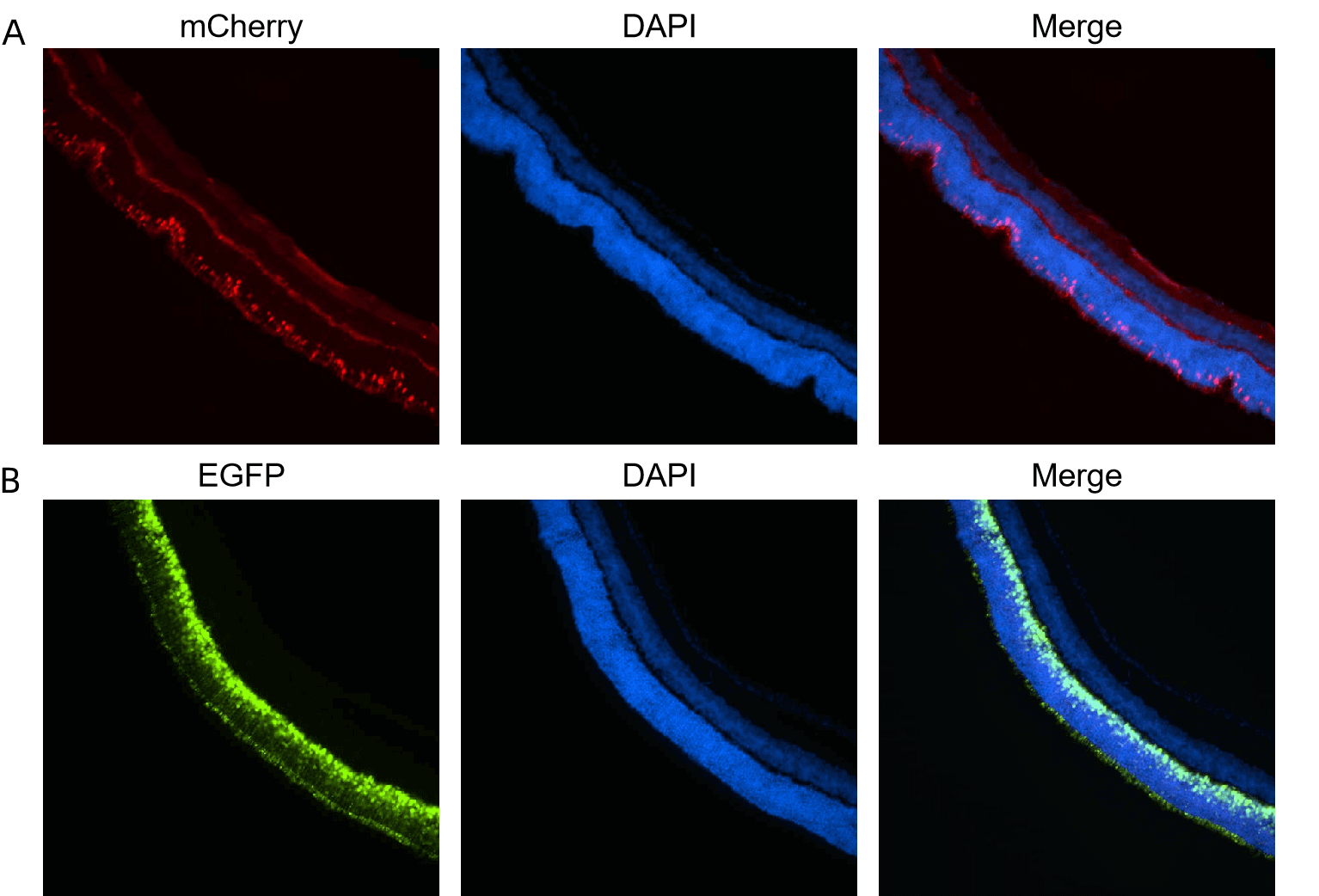
Figure 4. (A) AAV8 carrying ProA1 promoter에 의해 mCherry가 발현되는 AAV8 벡터 또는 (B) AAV8 carrying hRHO promoter에 의해 EGFP가 발현되는 AAV8 벡터를 subretinal injection에 의하여 마우스에 투여했습니다. mCherry, EGFP, 및 DAPI의 형광을 retina에서 분석하였습니다. 투여 후 20일 후의 이미지입니다.
당사의 CRO서비스에 대한 문의를 원하시면 cro@vectorbuilder.com으로 이메일을 보내주시기 바랍니다. 그밖의 다른 질문은 contact us를 통하여 해주시기 바랍니다.




