내가 좋아하는 클로닝 캐슬
우리 주변 세상에 대해 알수록 더 나은 삶을 만드는 데 필요한 자원이 더 많아집니다. Plasmid에서 CRISPR에 이르기까지 우리는 계속해서 자연계에서 발견하고 이를 추가 발견과 치료에 활용합니다. "내가 가장 좋아하는 빌딩 블록" 시리즈는 분자생물학에서 구축한 캐슬의 개별 조각을 가져와 자세히 조사합니다.
조각을 자세히 살펴보기 전에 잠시 시간을 내어 클로닝 및 plasmid에 대한 몇 가지 기본 사항을 검토하여 단계를 설정해 보겠습니다.
Plasmid
유전자를 도입하거나 조절하기 위해서는 일반적으로 plasmid로 시작합니다. 이 박테리아 DNA 조각은 원래 박테리아 세포 간의 유전자 전달 방법으로 1960년대에 발견되었지만 1970년대에 생물학자들은 유전물질을 plasmid에 도입할 수 있었습니다(Figure 1). 이러한 재조합 plasmid를 통해 과학자들은 박테리아 세포에서 유전자를 도입하고 유전자 발현을 조작할 수 있었습니다.
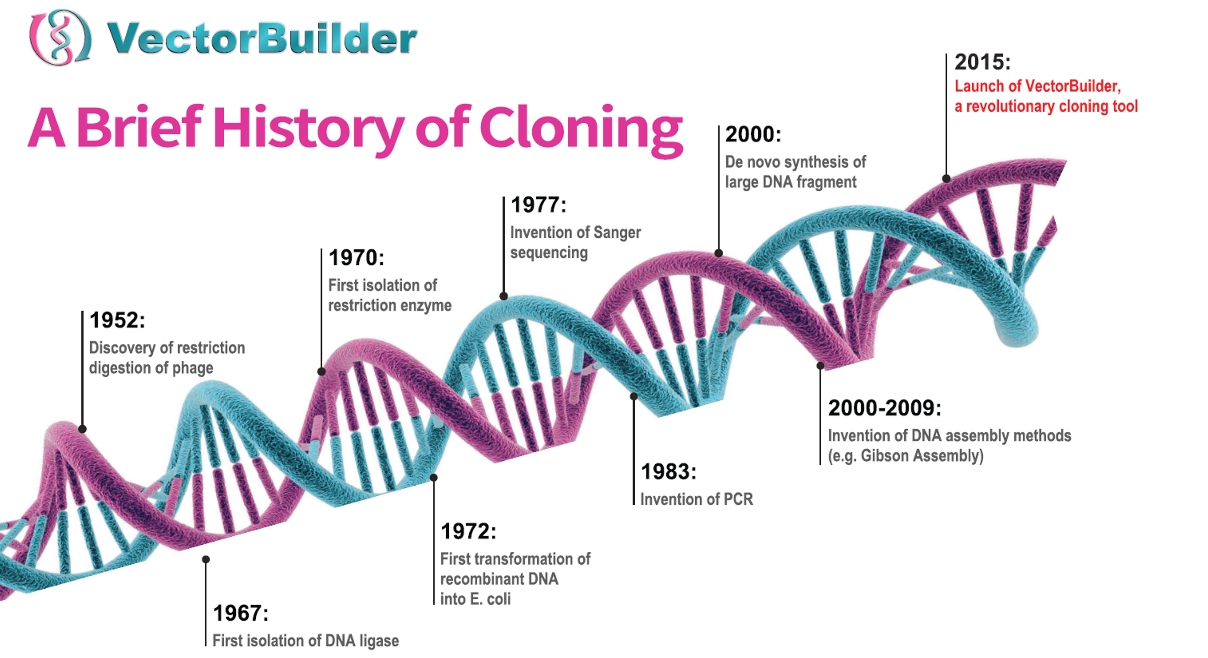
Figure 1. 클로닝의 주요 사건에 대한 간략한 역사.
재조합 plasmid 만들기
DNA를 plasmid에 통합하는데 필요한 단계는 각각 독립된 발견이었습니다. 이 발견이 함께 모여 분자생물학분야를 변형시켰습니다. 침입한 바이러스 DNA를 절단할 수 있는 박테리아세포에 대한 1960년대의 연구는 restriction endonucleases 또는 제한효소의 발견 및 분리로 이어졌습니다. 이 단백질은 모든 유기체의 특정 DNA서열에 결합하고 절단합니다. 두 개의 DNA 조각을 조립하려면 연결 또는 결합시켜야 합니다(Figure 2). 이것은 1960년대에 발견된 ligase라고 불리는 단백질에 의해 촉진됩니다. 이러한 돌파구는 모두 실험실에서 DNA 구조가 발견된 후 10-15년 이내에 발생했습니다.
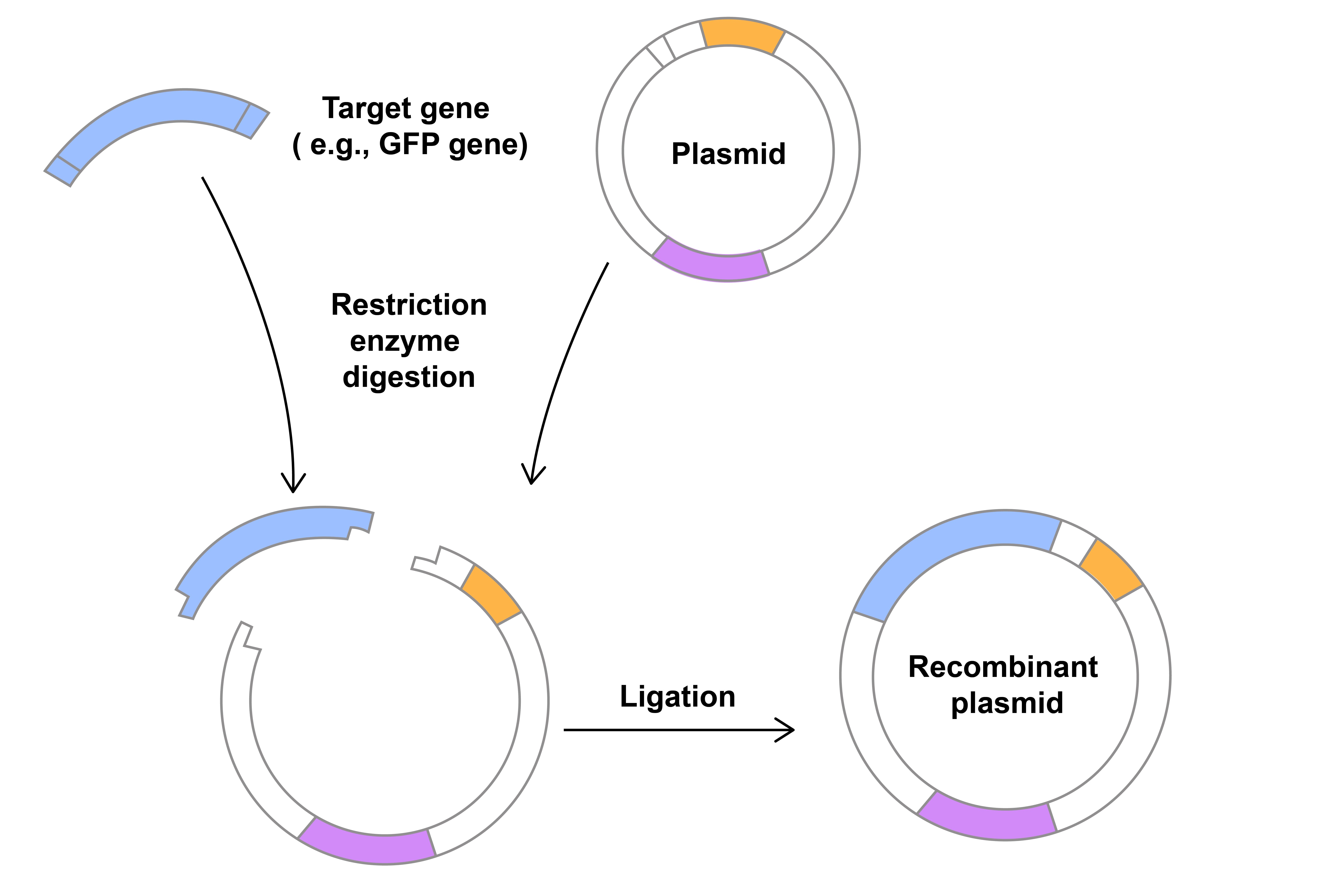
Figure 2. 유전자를 plasmid에 삽입하기 위한 절단 및 ligation.
재조합 plasmid가 생성된 후, 숙주세포가 증식함에 따라 plasmid가 복제될 수 있도록 박테리아 세포에 도입되어야 합니다. 세포 주변의 지질 이중층 때문에 plasmid와 같은 큰 분자는 도움 없이는 세포에 들어갈 수 없습니다. 대신, 열이나 전기를 사용한 짧은 충격으로 competent 박테리아 세포에 일시적으로 침투할 수 있도록 만드는 형질전환 기술이 사용됩니다.
DNA 만들기
현대 분자생물학에서는 유전물질을 plasmid에 효율적으로 도입하기 위해 종종 제한효소 이상의 것이 필요합니다. 생물학자들은 수백만 개의 DNA 단편 사본을 생성할 수 있으며 polymerase chain reaction (PCR)을 통해 이러한 DNA단편에 변화를 줄 수도 있습니다. PCR에서 짧은 DNA oligo(프라임)은 관심 영역의 양쪽 끝을 상보적으로 설계됩니다. 이 프라이머는 DNA의 상보적 서열에 결합하고 DNA 중합효소에 의해 복제를 시작합니다. 이 과정은 계속해서 반복되며 각각의 새로운 가닥은 프라이머의 새로운 주형이 됩니다(Figure 3). 지속적인 binding과 extension을 통해 단 몇 시간 만에 수백만에서 수십억 개의 목적서열의 복사본을 생성합니다. 이 PCR 증폭된 DNA 단편은 plasmid에 신속하게 ligase되어 재조합 plasmid에 대한 무한한 가능성을 창출할 수 있습니다.
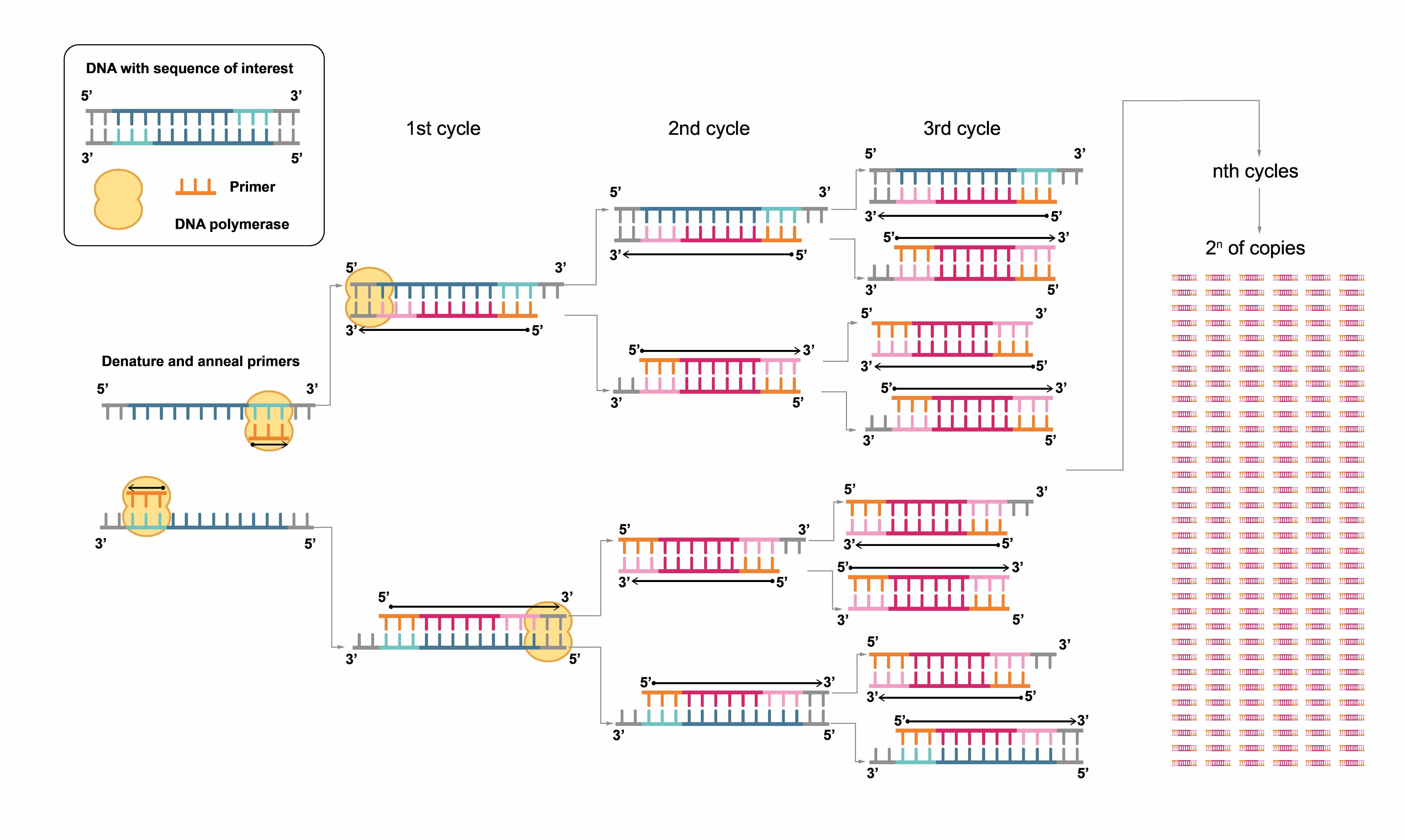
Figure 3. Polymerase chain reaction (PCR) 단계.
유전자 전달에서의 혁명
이러한 분자 기술을 통해 서열을 plasmid로 분리하고 복제할 수 있지만 특히 다른 유기체에서 기능을 연구하기 위해서는 절반의 고비를 넘은 것에 불과합니다. 일부 박테리아 균주는 형질전환을 통해 plasmid를 받아들일 수 있지만, 이러한 박테리아는 종종 다른 세포(예: 식물 또는 동물 세포)를 감염시키고 plasmid를 도입할 수 없습니다. 다른 유기체의 유전자를 연구하려면 일반적으로 유전 물질 도입을 위한 추가 단계가 필요합니다.
경우에 따라, plasmid는 바이러스를 사용하지 않는 트랜스펙션법을 통해 세포에 직접 도입될 수 있습니다. 여기에는 세포에 충격을 가해 plasmid DNA가 침투할 수 있게 되는 전기천공법 (electroporation)과 plasmid가 숙주세포와 병합되는 지질 이중층 내에 포함되는 리포펙션법(lipofection)이 포함됩니다. 그러나 트랜스펙션은 in vitro 또는 발달 모델에 크게 제한되며 일반적으로 분화된 세포 및 비분화 세포에서는 사용할 수 없습니다.
유전 물질을 세포에 도입하기 위해 바이러스를 사용하는 형질도입은 사용되는 특정 바이러스 시스템에 따라 각각의 장점과 단점이 있는 다양한 옵션을 제공합니다. 형질도입을 위한 재조합 바이러스를 생성하기 위해, 일반적으로 목적유전자 뿐만 아니라 바이러스 게놈의 일부를 포함하는 하나 이상의 plasmid를 HEK293과 같은 패키징 세포에 감염시킵니다. 형질감염 후, 세포는 바이러스 게놈을 사용하여 목적유전자를 포함하는 재조합 바이러스를 생성하고, 바이러스는 분리, 정제되고 in vitro와 in vivo 모두에서 표적 세포를 형질도입하는 데 사용할 수 있습니다.
렌티바이러스, 아데노바이러스, AAV, 레트로바이러스 등 바이러스 벡터 유형에 대한 많은 옵션이 있습니다. 이러한 바이러스는 각각 유전자 전달에 대한 특성과 장단점이 다르기 때문에 고려해야 할 요소가 많습니다. 다양한 바이러스는 AAV의 약 4.7kb에서 백시니아의 30kb에 이르기까지 목적 유전자를 운반하고 전달할 수 있는 능력이 매우 다양합니다. 또한 바이러스는 숙주 세포와 다르게 상호 작용합니다. 표적 세포의 폭인 tropism은 분열에서 비분열 세포, 줄기 세포로 분화, primary cell과 계대 세포로 다양합니다. 일단 세포에 들어가면 일부 바이러스는 외부 유전 물질을 염색체 외 또는 에피솜 DNA로 유지하는 반면 다른 바이러스는 숙주 게놈에 삽입됩니다. 마지막으로, 바이러스는 다양한 정도로 전체 숙주 유기체와 상호작용합니다. 일부는 숙주를 손상시킬 위험이 있고(병원성) 일부는 숙주 면역 반응을 유도합니다(면역원성). 둘 다 적절하게 제어되지 않으면 실험 결과를 모호하게 만들 수 있습니다
이 시리즈에서는 PCR, 유전자 발현 제어, 실험 설계 등 여기에서 설명한 모든 프로세스의 중요한 구성 요소에 대해 자세히 알아보겠습니다. 우리는 당신과 함께 클로닝 캐슬을 해체해 분석해 보기를 기대합니다.
Sources
Arber W. Host-controlled modification of bacteriophage. Annu Rev Microbiol. 1965;19:365-78. doi: 10.1146/annurev.mi.19.100165.002053. PMID: 5318444.
Cohen SN, Chang AC, Boyer HW, Helling RB. Construction of biologically functional bacterial plasmids in vitro. Proc Natl Acad Sci U S A. 1973 Nov;70(11):3240-4. doi: 10.1073/pnas.70.11.3240. PMID: 4594039; PMCID: PMC427208.
Hanahan D. Studies on transformation of Escherichia coli with plasmids. J Mol Biol. 1983 Jun 5;166(4):557-80. doi: 10.1016/s0022-2836(83)80284-8. PMID: 6345791.
Hasan MM, Ragnarsson L, Cardoso FC, Lewis RJ. Transfection methods for high-throughput cellular assays of voltage-gated calcium and sodium channels involved in pain. PLoS One. 2021 Mar 5;16(3):e0243645. doi: 10.1371/journal.pone.0243645. PMID: 33667217; PMCID: PMC7935312.
Jackson DA, Symons RH, Berg P. Biochemical method for inserting new genetic information into DNA of Simian Virus 40: circular SV40 DNA molecules containing lambda phage genes and the galactose operon of Escherichia coli. Proc Natl Acad Sci U S A. 1972 Oct;69(10):2904-9. doi: 10.1073/pnas.69.10.2904. PMID: 4342968; PMCID: PMC389671.
Lehman IR. DNA ligase: structure, mechanism, and function. Science. 1974 Nov 29;186(4166):790-7. doi: 10.1126/science.186.4166.790. PMID: 4377758.
Mullis K, Faloona F, Scharf S, Saiki R, Horn G, Erlich H. Specific enzymatic amplification of DNA in vitro: the polymerase chain reaction. Cold Spring Harb Symp Quant Biol. 1986;51 Pt 1:263-73. doi: 10.1101/sqb.1986.051.01.032. PMID: 3472723.
Neumann E, Schaefer-Ridder M, Wang Y, Hofschneider PH. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J. 1982;1(7):841-5. doi: 10.1002/j.1460-2075.1982.tb01257.x. PMID: 6329708; PMCID: PMC553119.
Watson JD, Crick FH. Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid. Nature. 1953 Apr 25;171(4356):737-8. doi: 10.1038/171737a0. PMID: 13054692.



